高中 | 金属性 非金属性的判断 题目答案及解析
稿件来源:高途
高中 | 金属性 非金属性的判断题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第二节 元素周期律
金属性 非金属性的判断
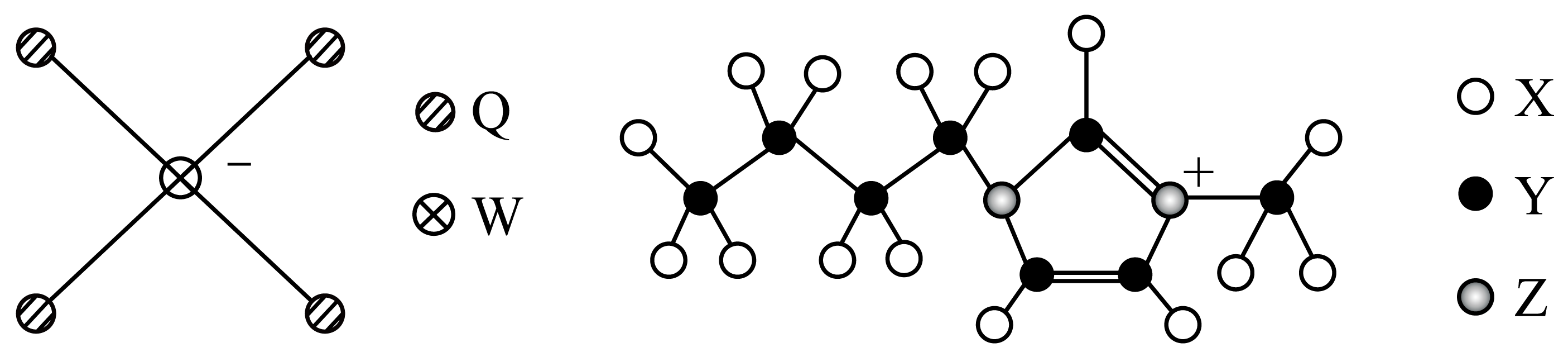
某盐可作防霉剂,其阴、阳离子结构如图所示,由$\rm X$、$\rm Y$、$\rm Z$、$\rm W$、$\rm Q$五种原子序数依次增大的短周期主族元素构成。其中基态$\rm Y$原子核外电子空间运动状态为$\rm 4$种,$\rm W$的简单离子半径在同周期中最小。下列说法正确的是$(\qquad)$
氢化物的沸点:$\\rm Y\\lt Z$
","最高价氧化物对应水化物酸性:$\\rm W\\gt Q$
","该盐所有原子均满足$\\rm 8$电子稳定结构
","第一电离能:$\\rm W\\lt Z$
"]$\rm Y$核外电子占据的原子轨道数为$\rm 4$,根据图示结构可知$\rm Y$原子可成$\rm 4$个共价键,推测$\rm Y$为$\rm C$元素;根据$\rm Z$成键方式及在结构中所带电荷可推测$\rm Z$为$\rm N$元素;$\rm X$均形成$\rm 1$个共价键,原子序数最小,推测为$\rm H$元素;$\rm W$的简单离子半径在同周期中最小,结合其成键结构,推测$\rm W$为$\rm Al$元素;$\rm Q$成单键,且原子序数大于$\rm W$,推测为$\rm Cl$元素,据此回答。
$\rm A$.$\rm Y$为$\rm C$元素,其氢化物有多种,无法与$\rm Z$氢化物比较沸点,$\rm A$错误;
$\rm B$.元素非金属性越强,最高价氧化物对应水化物的酸性越强,高氯酸酸酸性强于氢氧化铝,$\rm B$错误;
$\rm C$.由于$\rm H$的最外层只有$\rm 1$个电子,故该盐中$\rm H$原子不能满足$\rm 8$电子稳定结构,$\rm C$错误;
$\rm D$.$\rm N$元素的$\rm 2p$轨道为半满结构,能量较低,故:第一电离能:$\rm Cl\lt N$,$\rm D$正确。
故选:$\rm D$
高中 | 金属性 非金属性的判断题目答案及解析(完整版)
