| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,用$0.01\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ NaOH}$标准溶液滴定$20\;\rm \text{mL }0.01\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$三元酸${{\text{H}}_{3}}\text{A}\rm ({{\text{H}}_{3}}\text{A}$的第一步电离方程式为${{\text{H}}_{3}}\text{A}={{\text{H}}^{+}}+{{\text{H}}_{2}}{{\text{A}}^{-}}\rm )$,测得溶液的$\text{pH}$与氢氧化钠溶液体积的关系如图所示,下列说法正确的是$(\qquad)$
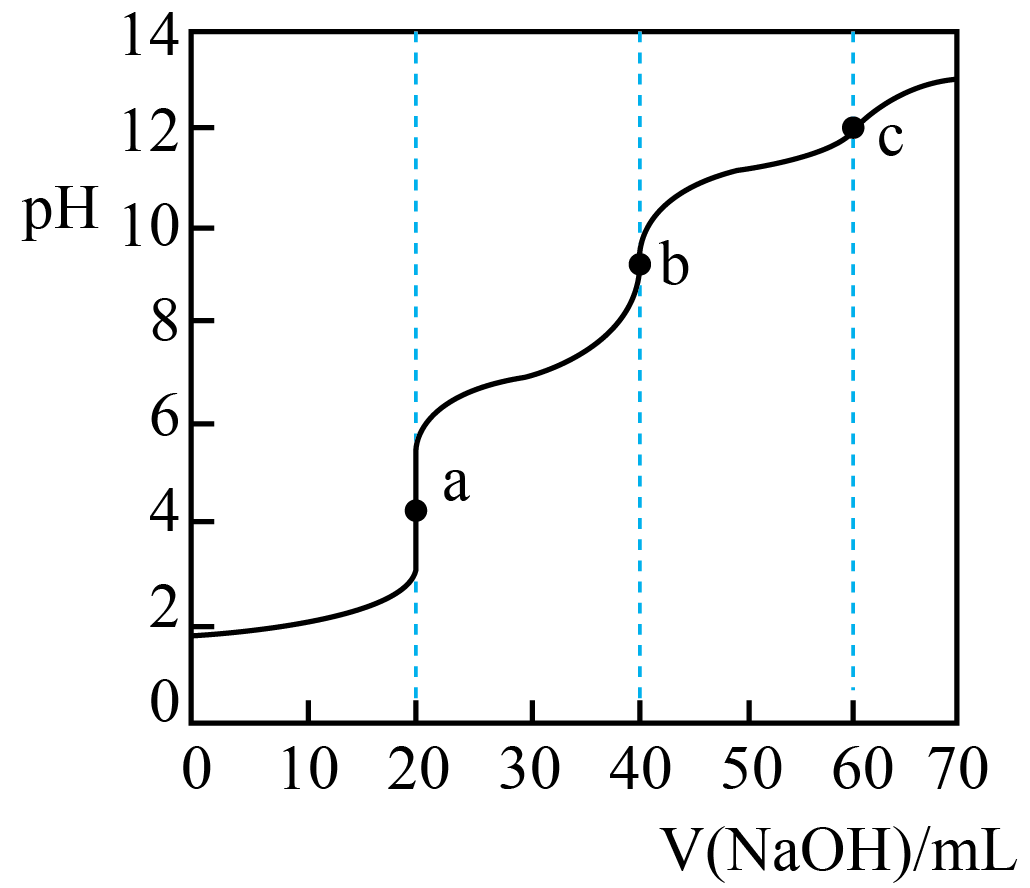
滴定过程中可用石蕊作指示剂
","$\\rm a$点满足:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\lt c\\left( \\text{H}{{\\text{A}}^{2-}} \\right)+c\\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)+c\\left( {{\\text{A}}^{3-}} \\right)$
","$\\rm b$点满足:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right)\\gt c\\left( \\text{H}{{\\text{A}}^{2-}} \\right)+c\\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)+c\\left( {{\\text{A}}^{3-}} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","随着氢氧化钠溶液的不断加入,水的电离程度不断增大
"]$\rm A$.由图像可知,滴定过程在$\rm pH$为$\rm 5$、$\rm 9$和$\rm 11$左右时存在滴定终点,而石蕊的变色范围为$\rm 5\sim 8$,所以滴定过程中不可用石蕊作指示剂,故$\rm A$错误;
$\rm B$.$\rm a$点时,加入$\rm NaOH$溶液的体积为$\rm 20\;\rm mL$,$\rm NaOH$与$\rm H_{3}A$恰好完全反应生成$\rm NaH_{2}A$,由物料守恒可知$c\left( \text{N}{{\text{a}}^{+}} \right)=c\left( {{\text{H}}_{3}}\text{A} \right)+c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)\gt c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)$,故$\rm B$错误;
$\rm C$.$\rm b$点时,加入$\rm NaOH$溶液的体积为$\rm 40\;\rm mL$,$\rm NaOH$与$\rm H_{3}A$恰好完全反应生成$\rm Na_{2}HA$,由电荷守恒可知$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=2c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+3c\left( {{\text{A}}^{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)\gt c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,故$\rm C$正确;
$\rm D$.加入氢氧化钠溶液$\rm 0\sim 20\;\rm mL$时,$\rm H_{3}A$电离产生的$ c\rm (H^{+})$不断减小,水的电离程不断增大,$\rm 20\sim 60\;\rm mL$时,溶液中先后生成$\rm HA^{2-}$、$\rm A^{3-}$,$\rm HA^{2-}$、$\rm A^{3-}$水解促使水的电离程度不断增大,大于$\rm 60\;\rm mL$时,过量的氢氧化钠抑制水的电离,使水的电离程度不断减小,所以随着氢氧化钠溶液的不断加入,水的电离程度先增大后减小,故$\rm D$错误。
故选:$\rm C$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
