高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
某钠离子电池以$\rm NaClO_{4}$的碳酸丙烯酯溶液作电解质溶液,$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$作正极材料,$\rm Na$作负极材料。
$\rm CO_{2}$与环氧丙烷在一定条件下反应制得碳酸丙烯酯。
①$\rm CO_{2}$是 $\rm ($填“极性”或“非极性”$\rm )$分子。
②环氧丙烷中,$\rm O$原子的杂化轨道类型是 杂化。
③沸点:环氧丙烷 $\rm CO_{2} ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
非极性;$\\rm sp^{3}$;$\\rm \\gt $
"]]①$\rm CO_{2}$分子中,$\rm C$原子的价层电子对数为$\dfrac{4}{2}\rm =2$,发生$\rm sp$杂化,分子呈直线形结构,是非极性分子。
②环氧丙烷分子中,$\rm O$原子与$\rm 2$个$\rm C$原子分别以单键相连,其价层电子对数为$\dfrac{6+2\times 1}{2}\rm =4$,杂化轨道类型是$\rm sp^{3}$杂化。
③环氧丙烷与$\rm CO_{2}$都形成分子晶体,环氧丙烷的相对分子质量大于$\rm CO_{2}$,分子间作用力环氧丙烷大于$\rm CO_{2}$,则沸点:环氧丙烷$\rm \gt CO_{2}$。
$\text{MnC}{{\text{l}}_{\text{2}}}$溶液与$\text{N}{{\text{a}}_{4}}\left[ \text{Fe}{{(\text{CN})}_{6}} \right]$溶液混合可制备$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$晶体。
①一个基态$\rm Mn$原子中的未成对电子数是 。
②$\rm CN^{-}$的性质与卤素离子相近,被称为拟卤离子,$\rm (CN)_{2}$被称为拟卤素。
$\rm i$.$\rm (CN)_{2}$与$\rm H_{2}O$反应的生成物的结构式分别是$\mathrm{H}-\mathrm{C} \equiv \mathrm{N}$、 。
ⅱ.$\rm HCN$有酸性但乙炔无明显酸性,$\rm HCN$的酸性比乙炔的强的原因是 。
$\\rm 5$;$\\mathrm{H}-\\mathrm{O}-\\mathrm{C} \\equiv \\mathrm{N}$;$\\rm N$原子的电负性大,$\\rm -CN$具有吸电子效应,使$\\rm HCN$中$\\rm H-C$的极性更大,更易断裂
"]]①$\rm Mn$的价电子的轨道表示式为![]() ,则一个基态$\rm Mn$原子中的未成对电子数是$\rm 5$。
,则一个基态$\rm Mn$原子中的未成对电子数是$\rm 5$。
②$\rm i$.$\rm Cl_{2}$与$\rm H_{2}O$反应,生成$\rm HCl$和$\rm HClO$,采用类推法,可确定$\rm (CN)_{2}$与$\rm H_{2}O$反应的生成物为$\rm HCN$、$\rm HOCN$,则结构式分别是$\mathrm{H}-\mathrm{C} \equiv \mathrm{N}$、$\mathrm{H}-\mathrm{O}-\mathrm{C} \equiv \mathrm{N}$。
ⅱ.$\rm HCN$有酸性但乙炔无明显酸性,乙炔为非极性分子而$\rm HCN$为极性分子,且$\rm H$、$\rm C$间的共用电子对偏离$\rm H$原子,则$\rm HCN$的酸性比乙炔的强,原因是:$\rm N$原子的电负性大,$\rm -CN$具有吸电子效应,使$\rm HCN$中$\rm H-C$的极性更大,更易断裂。
钠离子电池的正极材料$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$在充、放电过程中某时刻的晶胞示意图如下。
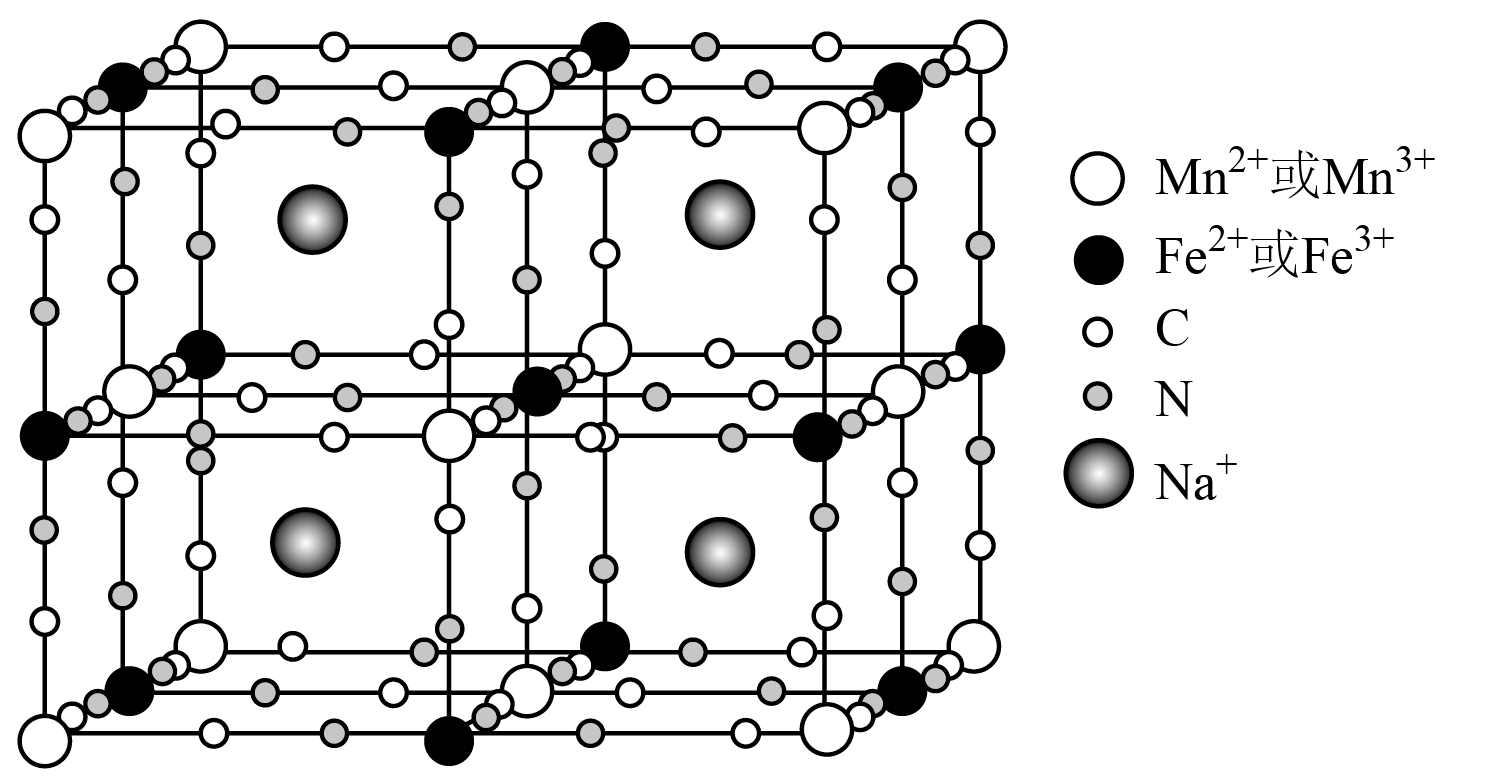
①$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$中存在的化学键有配位键、 。
②该时刻的晶胞所示的$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$中,$x=$ 。
离子键、$\\rm ($极性$\\rm )$共价键;$\\rm 1$
"]]①在$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$中,$\rm Na^{+}$与配离子间形成离子键,配离子中,金属离子与$\rm CN^{-}$间形成配位键,$\rm -CN$内$\rm C$、$\rm N$原子间形成$\rm ($极性$\rm )$共价键,则存在的化学键有配位键、离子键、$\rm ($极性$\rm )$共价键。
②由晶胞示意图可知,$\rm 4$个$\rm Na^{+}$位于体内,$\rm Mn$位于顶点和面心,$\rm Mn$原子的个数为$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}\rm =4$,则$\rm Na$与 $\rm Mn$的个数比为$\rm 4:4=1:1$,所以该时刻的晶胞所示的$\text{N}{{\text{a}}_{x}}\left[ \text{MnFe}{{(\text{CN})}_{6}} \right]$中,$x=1$。
高中 | 杂化轨道理论题目答案及解析(完整版)
