高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知:$\rm {{K}^{+}}$与冠醚$\rm b$结合能力强,使钾盐在该液体冠醚中溶解性好。
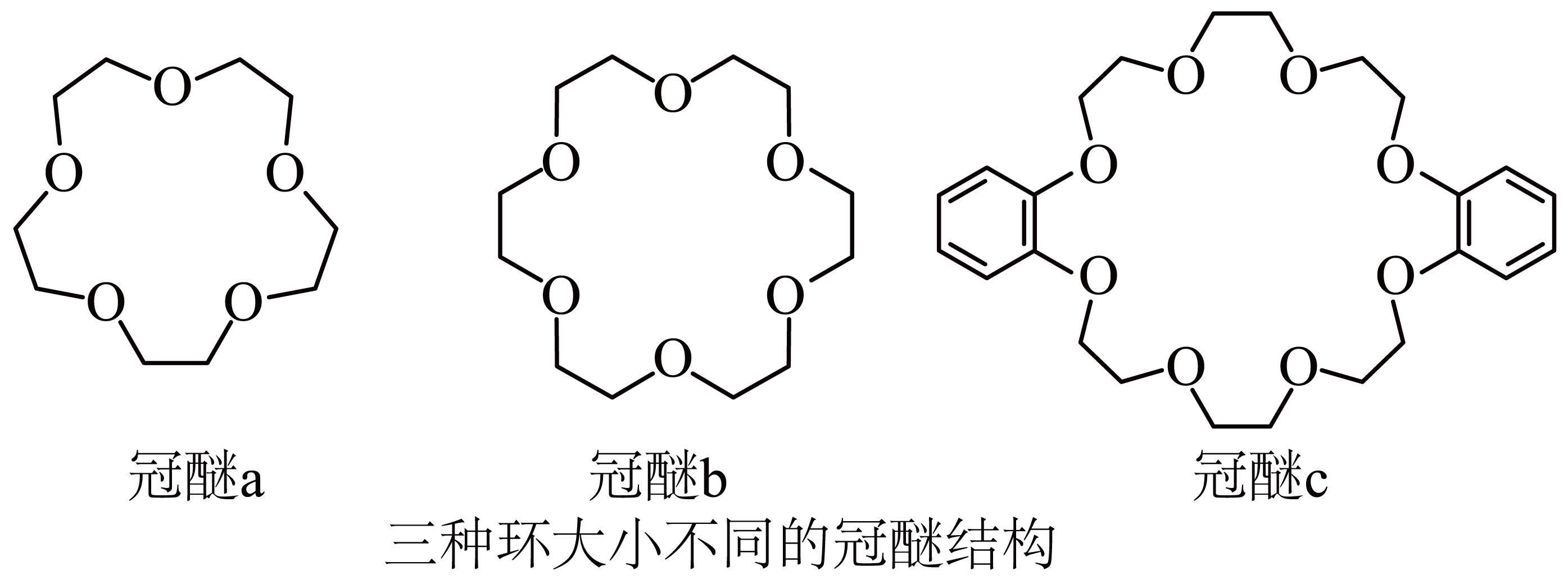
下列冠醚中$\rm O$原子的基态或激发态价电子中,能量由低到高排列的正确顺序为 。
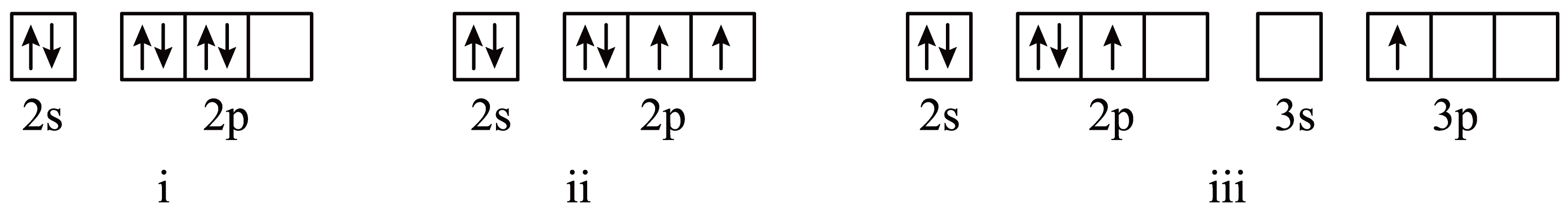
$\\rm ii\\lt i\\lt iii$
"]]能量$\rm 2s\lt 2p\lt 3s\lt 3p$,电子所在能级越高,该微粒能量越高;又由于$\rm i$所示电子排布不符合能量最低原理,所以能量比$\rm ii$高,则能量由低到高的顺序是$\rm ii\lt i\lt iii$。
$\rm KMn{{O}_{4}}$具有强氧化性,$\rm Mn$在元素周期表中的位置是 ,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚$\rm b$再加入$\rm KMn{{O}_{4}}$,氧化效果大幅度提升,原因是 。
第四周期第$\\rm VIIB$族;烯烃与水互不相溶,高锰酸钾与烯烃不易接触,加入冠醚后,烯烃在冠醚中溶解度好,同时$\\rm MnO_{4}^{-}$随钾离子进入冠醚溶液,$\\rm MnO_{4}^{-}$不与冠醚结合,游离的$\\rm MnO_{4}^{-}$与烯烃充分接触,反应活性高,反应速率快
"]]$\rm Mn$元素在周期表中的位置为第四周期第$\rm VIIB$族,根据相似相溶原理知,冠醚可溶于烯烃,加入冠醚中的钾离子因静电作用将高锰酸根离子带入烯烃中,增大反应物的接触面积,提高氧化效果,原因是:烯烃与水互不相溶,高锰酸钾与烯烃不易接触,加入冠醚后,烯烃在冠醚中溶解度好,同时$\rm MnO_{4}^{-}$随钾离子进入冠醚溶液,$\rm MnO_{4}^{-}$不与冠醚结合,游离的$\rm MnO_{4}^{-}$与烯烃充分接触,反应活性高,反应速率快。
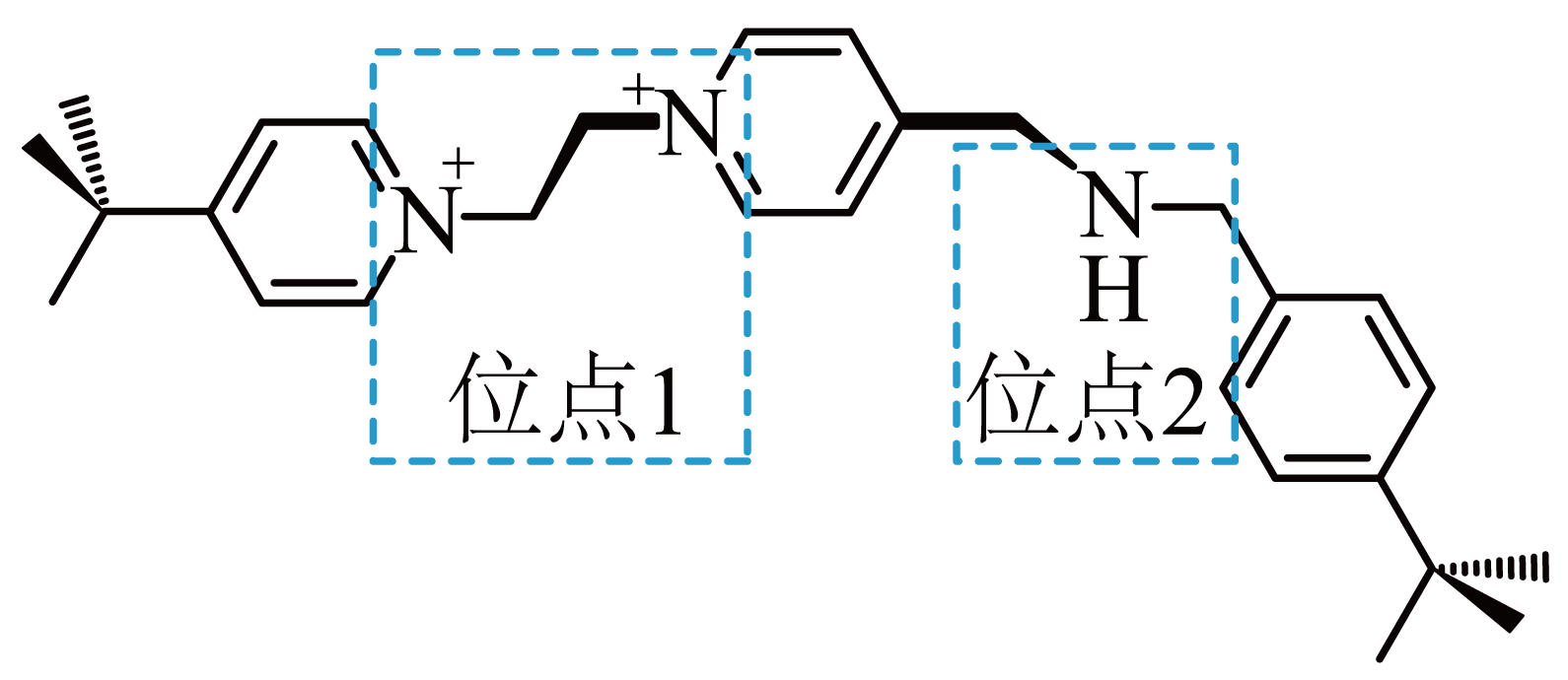
分子$\rm A($结构如图所示$\rm )$能与冠醚$\rm c$形成一种分子梭结构,其中$\rm N$的杂化为 ,该分子梭可以通过加入酸或碱使冠醚$\rm c$在位点$\rm 1$和位点$\rm 2$之间来回移动。加酸冠醚$\rm c$移动到位点$\rm 2$,冠醚$\rm c$与位点$\rm 2$之间的相互作用为 。
$\rm a$.静电相互作用
$\rm b$.离子键
$\rm c$.共价键
$\rm d$.氢键
$\\rm sp^{2}$、$\\rm sp^{3}$;$\\rm ad$
"]]环上的氮原子的价层电子对数为:$\rm 2+1=3$,故该$\rm N$原子为$\rm sp^{2}$杂化,$\rm -NH-$上的$\rm N$为$\rm sp^{3}$杂化,该分子梭可以通过加入酸或碱使冠醚$\rm c$在位点$\rm 1$和位点$\rm 2$之间来回移动,说明冠醚$\rm c$与位点$\rm 2$之间的相互作用为静电相互作用和氢键,故选:$\rm ad$。
$\rm C{{o}^{2+}}$与冠醚$\rm a$结合能力强,$\rm KCo{{F}_{3}}$有独特的电性、磁性和光致发光性能。
①$\rm C{{o}^{2+}}$的价电子排布式为 。
②$\rm KCo{{F}_{3}}$晶体结构如图所示,每个小正八面体的顶点均为$\rm F$原子,该立方晶胞中$\rm Co$的配位数为 ,该晶体密度为$\rm \rho\ g/c{{m}^{3}}$,则该晶胞的棱长为 $\rm pm$。
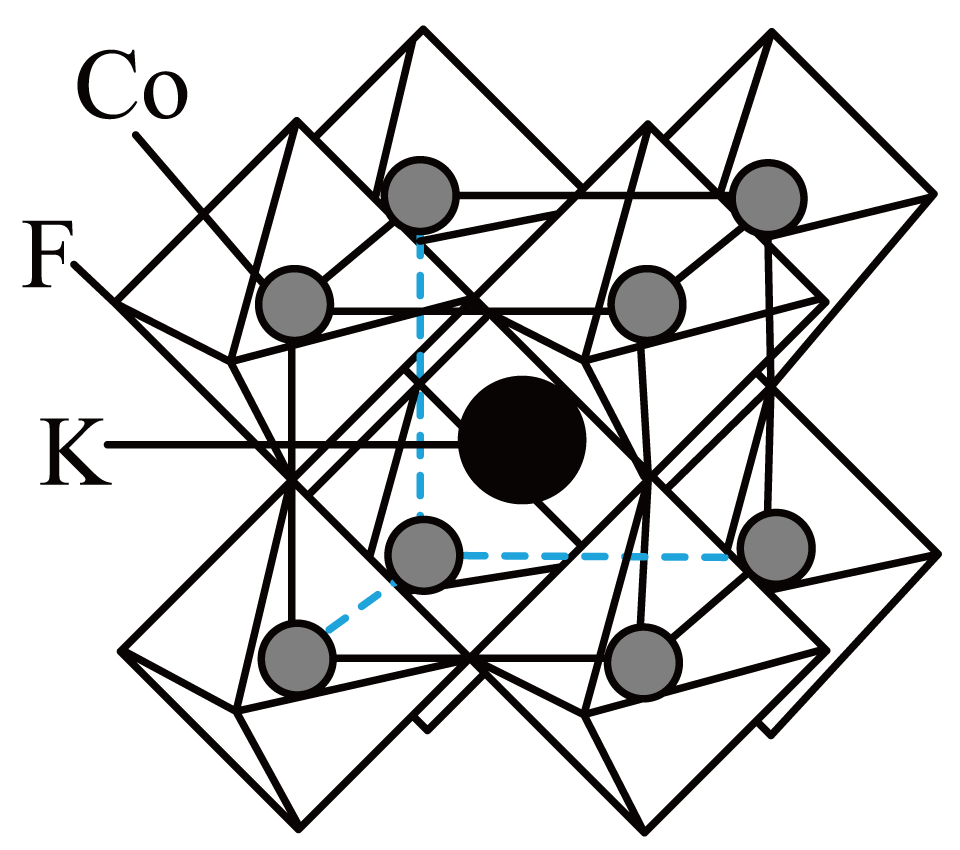
$\\rm 3d^{7}$;$\\rm 6$;$\\sqrt[3]{\\dfrac{155}{ \\rho{{N}_{\\rm A}}}}\\times {{10}^{10}}$
"]]①$\rm Co$是$\rm 27$号元素,故$\rm Co^{2+}$的价电子排布式为$\rm 3d^{7}$。
②每个小正八面体的顶点均为$\rm F$原子,面心是$\rm Co$原子,该立方晶胞中$\rm Co$的配位数为$\rm 6$;$\rm KCo{{F}_{3}}$晶胞质量$m=\dfrac{155}{{{N}_{\rm A}}}\ \rm g$,设该晶胞的棱长为$a\ \rm pm$,体积为$V=(a\times 10^{-10})^{3}\rm \ cm^{3}$,由晶体密度$\rho =\dfrac{m}{V}$,可得$a=\sqrt[3]{\dfrac{155}{\rho{{N}_{\rm A}}}}\times {{10}^{10}}\ \rm pm$。
高中 | 杂化轨道理论题目答案及解析(完整版)
