高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
神舟飞船材料由金属材料$\rm ($镁合金、钛合金、铝合金等$\rm )$和非金属材料加工而成。
钛具有较强抗腐蚀性及强度。
①基态钛原子的核外电子排布式为 。
②电子有两种相反的自旋状态,若一种自旋状态用$\rm +\dfrac{\text{1}}{\text{2}}$表示,与之相反的则用$\rm -\dfrac{\text{1}}{\text{2}}$表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为 。
③从原子结构角度解释$\rm TiCl_{3}$中$\rm +3$价钛元素还原性较强的原因 。
④$\rm Ti$的四卤化物熔点如下表所示,$\rm TiF_{4}$熔点高于其他三种卤化物,自$\rm TiCl_{4}$至$\rm TiI_{4}$熔点依次升高,原因是 。
| 化合物 | $\rm TiF_{4}$ | $\rm TiCl_{4}$ | $\rm TiBr_{4}$ | $\rm TiI_{4}$ |
| 熔点$\rm /^\circ\rm C$ | $\rm 377$ | $\rm -$ $\rm 24.12$ | $\rm 38.3$ | $\rm 155$ |
$\\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$;$\\rm +1$或$\\rm -1$;$\\rm Ti^{3+}$价层电子为$\\rm 3d^{1}$,失去一个电子后,$\\rm 3d$能级处于全空稳定状态,所以易失电子,还原性较强;$\\rm TiF_{4}$为离子晶体,熔点最高;$\\rm TiCl_{4}$、$\\rm TiBr_{4}$、$\\rm TiI_{4}$都是分子晶体,组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点依次升高
"]]①已知$\rm Ti$是$\rm 22$号元素,故基态钛原子的核外电子排布式为$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$;
②由钛的核外电子排布式可知,钛原子的$\rm 3d$能级上$\rm 2$个电子分占不同的轨道,且自旋方向相同,故对于基态钛原子,其价电子自旋磁量子数的代数和为$\rm +1$或$\rm -1$;
③$\rm Ti^{3+}$的价电子排布式为$\rm 3d^{1}$,失去$\rm 1$个电子后,$\rm 3d$能级处于全空稳定状态,所以$\rm Ti^{3+}$易失电子,还原性较强;
④$\rm TiF_{4}$为离子晶体,熔点最高;$\rm TiCl_{4}$、$\rm TiBr_{4}$、$\rm TiI_{4}$都是分子晶体,组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点依次升高。
氧化锆基陶瓷热障涂层是航天发动机的关键技术。下图为立方氧化锆晶胞示意图。
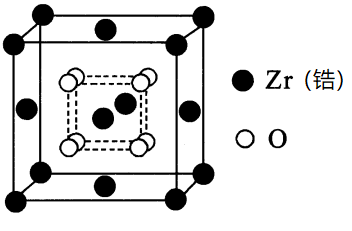
①氧化锆的化学式是 。
②每个$\rm Zr$原子周围紧邻的等距$\rm Zr$原子有 个。
$\\rm ZrO_{2}$;$\\rm 12$
"]]①由题干晶胞示意图可知,一个晶胞中含有$\rm Zr$个数为:$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}\rm =4$,$\rm O$的个数为:$\rm 8$,故$\rm Zr$和$\rm O$的个数最简比为$\rm 1:2$,故氧化锆的化学式是:$\rm ZrO_{2}$;
②由题干晶胞示意图可知,$\rm Zr$位于$\rm 8$个顶点和$\rm 6$个面心上,故每个$\rm Zr$原子周围紧邻的等距$\rm Zr$原子有$\dfrac{3\times8}{\text{2}}\rm =12$个。
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
