| 配合物理论 题目答案及解析
稿件来源:高途
| 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
尿素$\left[ \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}} \right]$含有的氨基中的$\rm N$原子可与${{\text{H}}^{+}}$形成配位键,原因是 。
氨基中的$\\rm N$原子含有孤电子对,而氢离子含有空轨道,故两者能形成配位键
"]]氨基中的$\rm N$原子含有孤电子对,而氢离子含有空轨道,故两者能形成配位键;
尿素溶液吸收烟气中的$\text{S}{{\text{O}}_{2}}$,生成一种正盐和$\text{C}{{\text{O}}_{2}}$,反应的化学方程式是 。
$\\left[ \\text{CO}{{\\left( \\text{N}{{\\text{H}}_{\\text{2}}} \\right)}_{\\text{2}}} \\right]\\text{+S}{{\\text{O}}_{\\text{2}}}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O=}{{\\left( \\text{N}{{\\text{H}}_{\\text{4}}} \\right)}_{\\text{2}}}\\text{S}{{\\text{O}}_{3}}\\text{+C}{{\\text{O}}_{\\text{2}}}$
"]]尿素溶液吸收烟气中的$\text{S}{{\text{O}}_{2}}$,生成一种正盐和$\text{C}{{\text{O}}_{2}}$,根据质量守恒可知,正盐为亚硫酸铵,故反应的化学方程式是$\left[ \text{CO}{{\left( \text{N}{{\text{H}}_{\text{2}}} \right)}_{\text{2}}} \right]\text{+S}{{\text{O}}_{\text{2}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=}{{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}\text{S}{{\text{O}}_{3}}\text{+C}{{\text{O}}_{\text{2}}}$;
研究发现,用尿素溶液吸收烟气中的$\rm NO$时,脱除率很低。若$\text{Cl}{{\text{O}}_{2}}$与尿素溶液联用,将$\rm NO$转化为$\text{N}{{\text{O}}_{2}}$,可大大提高$\rm NO$的脱除率。$\text{N}{{\text{O}}_{2}}$与$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$溶液反应可生成两种无毒无污染的气体,反应的化学方程式是 。
$\\text{6N}{{\\text{O}}_{2}}\\text{+4CO}{{\\left( \\text{N}{{\\text{H}}_{2}} \\right)}_{2}}\\text{=7}{{\\text{N}}_{2}}\\text{+4C}{{\\text{O}}_{2}}\\text{+8}{{\\text{H}}_{2}}\\text{O}$
"]]$\text{N}{{\text{O}}_{2}}$与$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$溶液反应可生成两种无毒无污染的气体,则$\text{N}{{\text{O}}_{2}}$中氮元素发生还原反应、$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$中氮元素发生氧化反应生成氮气,同时碳元素转化为二氧化碳,结合质量守恒可知,还生成水,反应为$\text{6N}{{\text{O}}_{2}}\text{+4CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}\text{=7}{{\text{N}}_{2}}\text{+4C}{{\text{O}}_{2}}\text{+8}{{\text{H}}_{2}}\text{O}$;
Ⅱ.$\text{Cl}{{\text{O}}_{2}}$气相脱硫脱硝
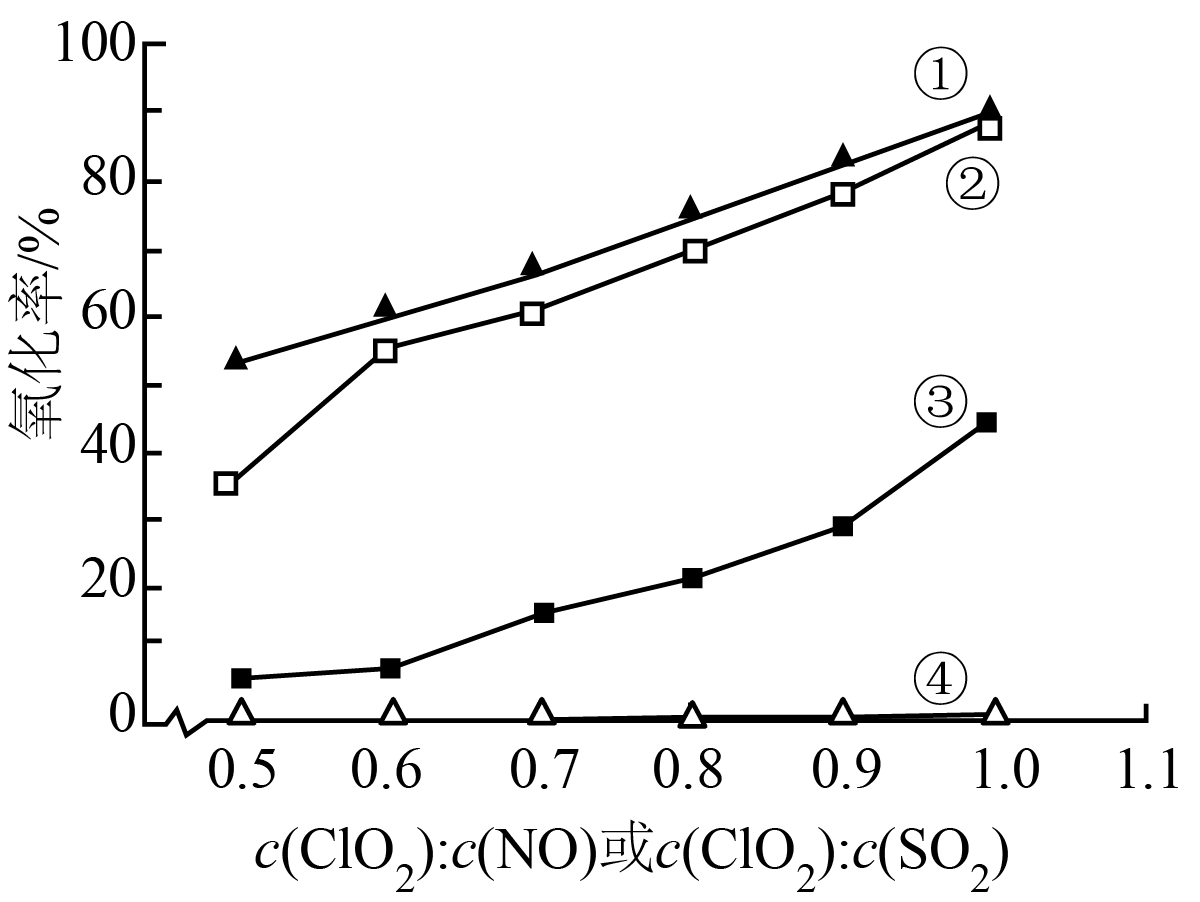
一定温度下,将模拟烟气通入气相氧化反应器中。$\rm NO$和$\text{S}{{\text{O}}_{2}}$的初始浓度相同,改变$\text{Cl}{{\text{O}}_{2}}$的浓度,相同时间内,气体的氧化率随$\text{Cl}{{\text{O}}_{2}}$与$\rm NO$或$\text{S}{{\text{O}}_{2}}$的物质的量浓度之比的变化如图所示。其中①、④分别为$\rm NO$和$\text{S}{{\text{O}}_{2}}$单独通入反应器时$\rm NO$、$\text{S}{{\text{O}}_{2}}$的氧化率,②、③分别为将$\rm NO$和$\text{S}{{\text{O}}_{2}}$同时通入反应器时$\rm NO$、$\text{S}{{\text{O}}_{2}}$的氧化率。
已知:对于确定的基元反应,反应速率$\rm (v)$与速率常数$\rm (k)$成正比。
$\text{Cl}{{\text{O}}_{2}}$气相氧化$\rm NO$的关键基元反应:
基元反应$\rm 1$:$\text{NO}+\text{Cl}{{\text{O}}_{2}}=\text{N}{{\text{O}}_{2}}+\text{ClO}\quad {{k}_{1}}=1.7\times {{10}^{11}}$
基元反应$\rm 2$:$\text{NO}+\text{ClO}=\text{N}{{\text{O}}_{2}}+\text{Cl}\quad {{k}_{2}}=8.8\times {{10}^{12}}$
$\text{Cl}{{\text{O}}_{2}}$气相氧化$\text{S}{{\text{O}}_{2}}$的关键基元反应:
基元反应$\rm 3$:$\text{S}{{\text{O}}_{2}}+\text{Cl}{{\text{O}}_{2}}=\text{S}{{\text{O}}_{3}}+\text{ClO}\quad {k}_{3}=2.1\times {{10}^{-4}}$
基元反应$\rm 4$:$\text{S}{{\text{O}}_{2}}+\text{ClO}=\text{S}{{\text{O}}_{3}}+\text{Cl}\quad {{k}_{4}}=6.9\times {{10}^{11}}$
$\text{Cl}{{\text{O}}_{2}}$单独氧化$\text{S}{{\text{O}}_{2}}$时,氧化率很低。原因是 。
基元反应$\\rm 3$的${{k}_{3}}$很小,导致其反应速率很小,使得$\\text{Cl}{{\\text{O}}_{2}}$单独氧化$\\text{S}{{\\text{O}}_{2}}$的总反应速率很低
"]]已知:对于确定的基元反应,反应速率$ (v)$与速率常数$ (k)$成正比。由题干可知,基元反应$\rm 3$的${{k}_{3}}$很小,导致其反应速率很小,使得$\text{Cl}{{\text{O}}_{2}}$单独氧化$\text{S}{{\text{O}}_{2}}$的总反应速率很低,氧化率很低;
将$\text{S}{{\text{O}}_{2}}$和$\rm NO$同时通入气相氧化反应器中时,$\text{S}{{\text{O}}_{2}}$和$\rm NO$的氧化率与将其单独通入反应器中时不同。原因分别是 。
${{k}_{1}}$很大,基元反应$\\rm 1$速率很快,使得$\\rm ClO$浓度增大,导致基元反应$\\rm 4$速率增大,,使得二氧化硫的氧化率得到提高;又因为部分$\\rm ClO$参与了基元反应$\\rm 4$,使得与$\\rm NO$反应的$\\rm ClO$的浓度减小,导致$\\rm NO$的氧化率降低
"]]与将其单独通入反应器中相比,$\text{S}{{\text{O}}_{2}}$和$\rm NO$同时通入气相氧化反应器中,因为${{k}_{1}}$很大,基元反应$\rm 1$速率很快,使得$\rm ClO$浓度增大,导致基元反应$\rm 4$速率增大,,使得二氧化硫的氧化率得到提高;又因为部分$\rm ClO$参与了基元反应$\rm 4$,使得与$\rm NO$反应的$\rm ClO$的浓度减小,导致$\rm NO$的氧化率降低;
当体系中有水蒸气时,$\text{Cl}{{\text{O}}_{2}}$单独氧化$\text{S}{{\text{O}}_{2}}$的氧化率有很大提升。研究表明,此时$\text{S}{{\text{O}}_{2}}$被氧化不再经历基元反应$\rm 3$和基元反应$\rm 4$,而是生成两种常见的强酸。反应的化学方程式是 。
$\\text{2Cl}{{\\text{O}}_{\\text{2}}}\\text{+5S}{{\\text{O}}_{\\text{2}}}\\text{+6}{{\\text{H}}_{\\text{2}}}\\text{O=5}{{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}\\text{+2HCl}$
"]]当体系中有水蒸气时,$\text{Cl}{{\text{O}}_{2}}$单独氧化$\text{S}{{\text{O}}_{2}}$的氧化率有很大提升,此时$\text{S}{{\text{O}}_{2}}$被氧化生成两种常见的强酸,结合质量守恒可知,反应生成硫酸和盐酸,反应为$\text{2Cl}{{\text{O}}_{\text{2}}}\text{+5S}{{\text{O}}_{\text{2}}}\text{+6}{{\text{H}}_{\text{2}}}\text{O=5}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\text{+2HCl}$。
| 配合物理论题目答案及解析(完整版)
