高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
某小组同学探究$\text{CuS}{{\text{O}}_{4}}$溶液与$\text{N}{{\text{a}}_{2}}\text{S}$溶液的反应。
资料:ⅰ。$\rm S$为黄色固体,难溶于水,不与盐酸反应,在浓碱条件下会发生歧化。
ⅱ。$\rm CuS$为黑色固体,难溶于水,不与盐酸或$\rm NaOH$溶液反应。
ⅲ。$\rm BaS$为白色固体,易溶于水。
[理论分析]
假设Ⅰ:$\text{CuS}{{\text{O}}_{4}}$溶液与$\rm Na$₂$\rm S$溶液能发生复分解反应。
假设Ⅱ:$\text{CuS}{{\text{O}}_{4}}$溶液与$\rm Na$₂$\rm S$溶液能发生氧化还原反应。
若假设Ⅰ成立,则发生反应的离子方程式为 。
$\\text{C}{{\\text{u}}^{2+}}+{{\\text{S}}^{2-}}=\\text{CuS}\\downarrow $
"]]若假设Ⅰ成立,则$\rm CuSO_{4}$与$\rm Na_{2}S$发生复分解反应,产生黑色沉淀$\rm CuS$和硫酸钠溶液,发生反应的离子方程式为$\text{C}{{\text{u}}^{2+}}+{{\text{S}}^{2-}}=\text{CuS}\downarrow $。
从化合价的角度看,提出假设Ⅱ的依据是 。
$\\text{C}{{\\text{u}}^{2+}}$中的铜元素为$\\rm +2$价,处于铜元素的较高价态,$\\text{C}{{\\text{u}}^{2+}}$可能具有氧化性;${{\\text{S}}^{2-}}$中的硫元素为$\\rm -2$价,处于硫元素的最低价态,${{\\text{S}}^{2-}}$可能具有还原性
"]]氧化还原反应中有电子转移,表现为元素化合价发生变化,则从化合价的角度看提出假设Ⅱ的依据是:$\text{C}{{\text{u}}^{2+}}$中的铜元素为$\rm +2$价,处于铜元素的较高价态,$\text{C}{{\text{u}}^{2+}}$可能具有氧化性;${{\text{S}}^{2-}}$中的硫元素为$\rm -2$价,处于硫元素的最低价态,${{\text{S}}^{2-}}$可能具有还原性。
[实验验证]
实验Ⅰ:将一定浓度的$\text{CuS}{{\text{O}}_{4}}$溶液和$\text{N}{{\text{a}}_{2}}\text{S}$溶液等体积混合,迅速产生大量黑色固体、少量红色固体和黄色固体。在空气中静置一段时间,红色固体减少、黑色固体增多。
经检验,红色固体为$\rm Cu$。补全红色固体在空气中转化为黑色固体时所发生反应的离子方程式:
$2\text{Cu}+2{{\text{S}}^{2-}}+$ $\rm +$ ${{\text{H}}_{2}}\text{O}=2\text{CuS}+$
$2\\text{Cu}+2{{\\text{S}}^{2-}}+{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}=2\\text{CuS}+4\\text{O}{{\\text{H}}^{-}}$
"]]将一定浓度的$\text{CuS}{{\text{O}}_{4}}$溶液和$\text{N}{{\text{a}}_{2}}\text{S}$溶液等体积混合,迅速产生大量黑色固体、少量红色固体和黄色固体。黑色固体为$\rm CuS$,红色固体为$\rm Cu$,黄色固体为$\rm S$,静置后红色固体$\rm Cu$减少、黑色固体增多,结合所给的不完整的方程式可知铜被空气中氧气氧化为铜离子,铜离子和硫离子转化为硫化铜黑色沉淀,按得失电子守恒可知道存在关系式$\text{2Cu}\sim {{\text{O}}_{\text{2}}}\sim \text{2CuS}$,结合电荷守恒元素质量守恒,可得反应的离子方程式为:$2\text{Cu}+2{{\text{S}}^{2-}}+{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=2\text{CuS}+4\text{O}{{\text{H}}^{-}}$。
通过下列实验证实,黄色固体为$\rm S$。
实验Ⅱ:将实验Ⅰ中固体依次用盐酸、蒸馏水洗涤干净,并按如下方案检验。
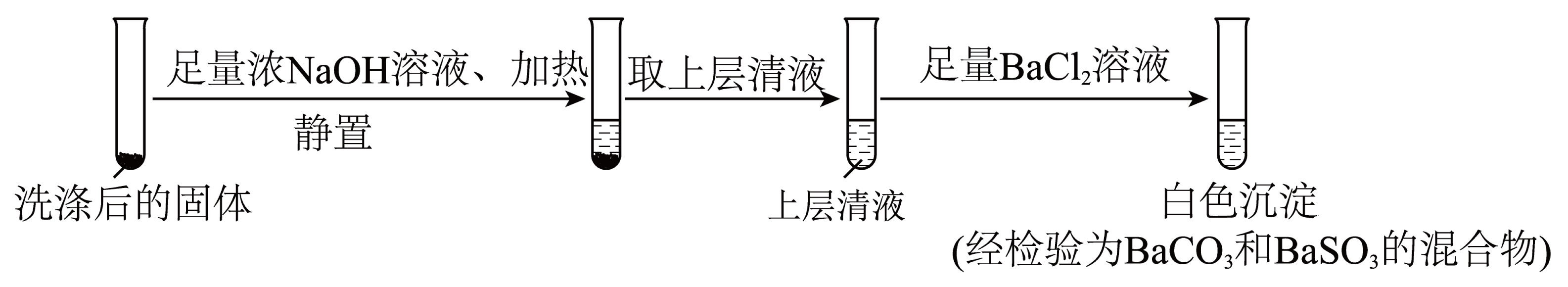
①洗涤实验Ⅰ中固体的目的是为了防止 $\rm ($填离子符号$\rm )$对后续实验产生干扰。
②在上述实验中,$\rm S$发生歧化反应的离子方程式为 。
$\\text{SO}_{4}^{2-}$、${{\\text{S}}^{2-}}$;$3\\text{S}+6\\text{O}{{\\text{H}}^{-}}\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array}2{{\\text{S}}^{2-}}+\\text{SO}_{3}^{2-}+3{{\\text{H}}_{2}}\\text{O}$
"]]①为了避免加入$\rm BaCl_{2}$时生成$\rm BaSO_{4}$沉淀、防止引入硫离子,故需要排除硫酸根、硫离子的干扰,实验Ⅰ中依次用盐酸、蒸馏水洗涤固体的目的是:为了防止$\rm S^{2-}$、$\text{SO}_{4}^{2-}$ $\rm ($填离子符号$\rm )$对后续实验产生干扰。
②在上述实验中,$\rm S$发生歧化反应转化为硫化钠与亚硫酸钠,离子方程式为$3\text{S}+6\text{O}{{\text{H}}^{-}}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array}2{{\text{S}}^{2-}}+\text{SO}_{3}^{2-}+3{{\text{H}}_{2}}\text{O}$。
[实验结论]
根据以上实验,该小组得出的结论是 。
$\\text{CuS}{{\\text{O}}_{4}}$溶液与$\\text{N}{{\\text{a}}_{2}}\\text{S}$溶液混合时,二者之间既能发生复分解反应,又能发生氧化还原反应
"]]根据以上实验,该小组得出的结论是: $\text{CuS}{{\text{O}}_{4}}$溶液与$\text{N}{{\text{a}}_{2}}\text{S}$溶液混合时,二者之间既能发生复分解反应,又能发生氧化还原反应。
高中 | 离子方程式题目答案及解析(完整版)
