高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
$\rm NaCl$是一种化工原料,可以制备多种物质,如下图所示。
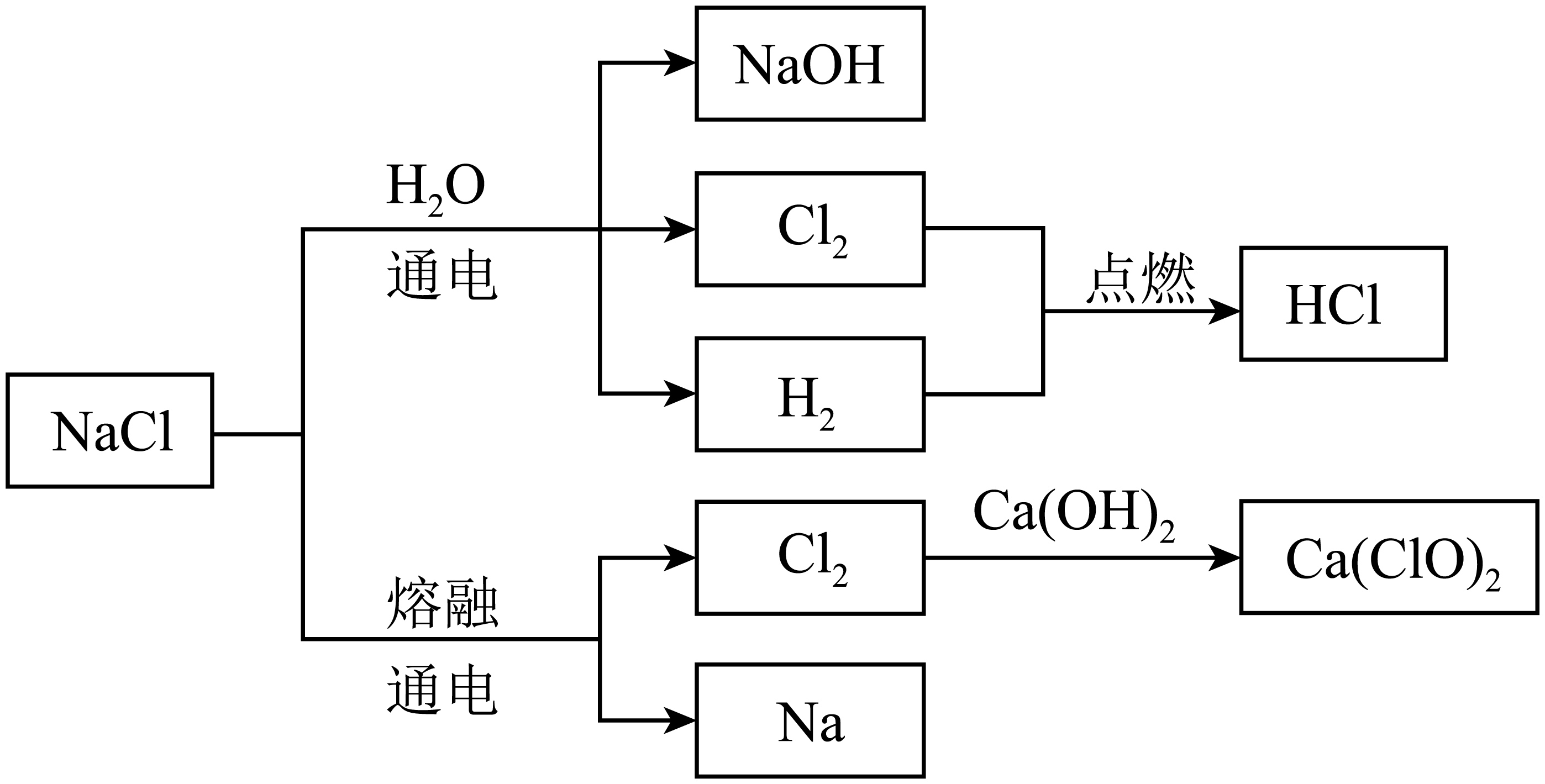
氯碱工业通过电解饱和$\rm NaCl$溶液制得$\text{NaOH}$、${{\text{H}}_{2}}$和$\text{C}{{\text{l}}_{2}}$,并以它们为原料生产一系列化工产品。
①$\rm NaC1$溶液通电后,发生反应的化学方程式为 。
②若电解饱和$\rm NaCl$溶液时消耗了$\rm 117\;\rm g$ $\rm NaCl$,则生成$\text{C}{{\text{l}}_{2}}$的体积在标准状况下为 $\rm \;\rm L$,该过程中转移电子的物质的量为 $\rm \;\rm mol$。
③上述反应制得的${{\text{H}}_{2}}$和$\text{C}{{\text{l}}_{2}}$可用于生产盐酸。${{\text{H}}_{2}}$在$\text{C}{{\text{l}}_{2}}$中燃烧的现象是 。
$\\text{2NaCl+2}{{\\text{H}}_{\\text{2}}}\\text{O}\\begin{matrix} \\underline{\\underline{通电}} \\\\ {} \\\\ \\end{matrix}\\text{C}{{\\text{l}}_{\\text{2}}}\\uparrow +{{\\text{H}}_{\\text{2}}}\\uparrow \\text{+2NaOH}$; $\\rm 22.4$;$\\rm 2$;安静地燃烧,发出苍白色火焰
"]]①$\rm NaC1$溶液通电后,发生反应$\text{2NaCl+2}{{\text{H}}_{\text{2}}}\text{O}\begin{matrix} \underline{\underline{通电}} \\ {} \\ \end{matrix}\text{C}{{\text{l}}_{\text{2}}}\uparrow +{{\text{H}}_{\text{2}}}\uparrow \text{+2NaOH}$;
②根据化学方程式可知$\text{2NaCl}\sim \text{C}{{\text{l}}_{\text{2}}}\sim 2{{\text{e}}^{-}}$,消耗了$\rm 117\;\rm g$ $\rm NaCl$为$\rm 2\;\rm mol$,则生成$\rm 1\;\rm mol\text{ C}{{\text{l}}_{2}}$的体积在标准状况下为$\rm 22.4\;\rm L$;转移电子为$\rm 2\;\rm mol$;
③${{\text{H}}_{\text{2}}}$与$\text{C}{{\text{l}}_{2}}$点燃条件下发生反应$\text{C}{{\text{l}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\begin{matrix} \underline{\underline{点燃}} \\ {} \\ \end{matrix}\text{2HCl}$,${{\text{H}}_{2}}$在$\text{C}{{\text{l}}_{2}}$中安静地燃烧,发出苍白色火焰。
氯碱工业的一道重要工序是除去原料粗食盐水中的可溶性杂质。
①为除去粗食盐水中的$\rm \text{C}{{\text{a}}^{2+}}$、$\rm \text{M}{{\text{g}}^{2+}}$、$\rm \text{SO}_{4}^{2-}$,加入试剂顺序合理的是 。
$\rm A$.$\rm NaOH$溶液、$\rm \text{BaC}{{\text{l}}_{2}}$溶液、$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液、盐酸
$\rm B$.$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液、$\rm NaOH$溶液、$\rm \text{BaC}{{\text{l}}_{2}}$溶液、盐酸
$\rm C$.$\rm \text{BaC}{{\text{l}}_{2}}$溶液、$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液、$\rm NaOH$溶液、盐酸
②用离子方程式说明上述流程中加入盐酸的目的: 。
$\\rm AC$;$\\text{O}{{\\text{H}}^{-}}+{{\\text{H}}^{+}}={{\\text{H}}_{2}}\\text{O}$、$\\text{CO}_{3}^{2-}\\text{+2}{{\\text{H}}^{+}}={{\\text{H}}_{2}}\\text{O+C}{{\\text{O}}_{2}}\\uparrow $
"]]①为除去粗食盐水中的$\text{C}{{\text{a}}^{2+}}$、$\text{M}{{\text{g}}^{2+}}$、$\text{SO}_{4}^{2-}$,分别用$\rm Na_{2}CO_{3}$、$\rm NaOH$和$\rm BaCl_{2}$,通过如下操作可除去这些离子:加入稍过量的$\text{NaOH}$溶液;加入稍过量的$\text{BaC}{{\text{l}}_{2}}$溶液;加入稍过量的$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液;滴入稀盐酸直至无气泡产生;为了除杂更干净,所加试剂必须过量,需保证$\rm Na_{2}CO_{3}$在$\rm BaCl_{2}$之后加;
②过滤后再加入稀盐酸以除杂过量的碳酸根和$\rm OH^{-}$,发生反应为$\text{O}{{\text{H}}^{-}}+{{\text{H}}^{+}}={{\text{H}}_{2}}\text{O}$、$\text{CO}_{3}^{2-}\text{+2}{{\text{H}}^{+}}={{\text{H}}_{2}}\text{O+C}{{\text{O}}_{2}}\uparrow $。
将$\text{C}{{\text{l}}_{2}}$通入冷的石灰乳中,可以得到以$\text{Ca}{{(\text{ClO})}_{2}}$为有效成分的漂白粉。
①上述反应的化学方程式为 。
②漂白粉中的$\text{Ca}{{(\text{ClO})}_{2}}$能与空气中的$\text{C}{{\text{O}}_{2}}$和水蒸气发生如下反应:$\text{Ca}{{(\text{ClO})}_{2}}+\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\text{O}=\text{CaC}{{\text{O}}_{3}}+2\text{HClO}$。根据以上反应,用化学用语说明漂白粉通常应避光并置于阴凉处密封保存的原因: 。
$\\rm \\text{2C}{{\\text{l}}_{2}}\\text{+2Ca}{{(\\text{OH})}_{2}}=\\text{Ca}{{(\\text{ClO})}_{2}}+\\text{CaC}{{\\text{l}}_{\\text{2}}}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O}$;漂白粉中的有效成分$\\rm \\text{Ca}{{(\\text{ClO})}_{2}}$与空气中的$\\rm \\text{C}{{\\text{O}}_{2}}$、水蒸气发生反应:$\\rm \\text{Ca}{{(\\text{ClO})}_{2}}+\\text{C}{{\\text{O}}_{2}}+{{\\text{H}}_{2}}\\text{O}=\\text{CaC}{{\\text{O}}_{3}}+2\\text{HClO}$,$\\rm \\text{HClO}$不稳定见光易分解,$\\rm 2HClO\\begin{array}{*{20}{c}}{\\underline{\\underline {光照}} }\\\\{}\\end{array}2HCl+{{\\text{O}}_{2}}\\uparrow $,导致漂白粉失效
"]]①将$\rm \text{C}{{\text{l}}_{2}}$通入冷的石灰乳中发生反应$\rm \text{2C}{{\text{l}}_{2}}\text{+2Ca}{{(\text{OH})}_{2}}=\text{Ca}{{(\text{ClO})}_{2}}+\text{CaC}{{\text{l}}_{\text{2}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O}$;
②漂白粉中的有效成分$\rm \text{Ca}{{(\text{ClO})}_{2}}$与空气中的$\rm \text{C}{{\text{O}}_{2}}$、水蒸气发生反应:$\rm \text{Ca}{{(\text{ClO})}_{2}}+\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\text{O}=\text{CaC}{{\text{O}}_{3}}+2\text{HClO}$,$\rm \text{HClO}$不稳定见光易分解,导致漂白粉失效,所以漂白粉通常应避光并置于阴凉处密封保存。
高中 | 氯气题目答案及解析(完整版)
