高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
二氧化氯$\rm (ClO_{2})$具体以强氧化性,是一种比较安全的消毒剂。实验小组以氯气和亚氯酸钠$\rm (NaClO_{2})$为原料制备二氧化氯$\rm (ClO_{2})$并探究其性质。
资料:ⅰ$\rm .ClO_{2}$为黄绿色气体,易溶于水,难溶于$\rm CCl_{4}$;$\rm Cl_{2}$易溶于$\rm CCl_{4}$中,溶液呈黄绿色。
ⅱ$\rm .CCl_{4}$为无色液体,密度比水大,且与水不互溶。
ⅲ$\rm .NaClO_{2}$溶液呈弱碱性,在酸性溶液中,$\rm NaClO_{2}$易发生下列反应:$8\text{ClO}_{2}^{-}+8{{\text{H}}^{+}}=6\text{Cl}{{\text{O}}_{2}}\uparrow +\text{C}{{\text{l}}_{2}}\uparrow +4{{\text{H}}_{2}}\text{O}$。
[实验一:制备$\rm ClO_{2}$]进行如下图所示实验,实验过程中,持续通入$\rm N_{2}$使$\rm C$中生成的$\rm ClO_{2}$逸出。
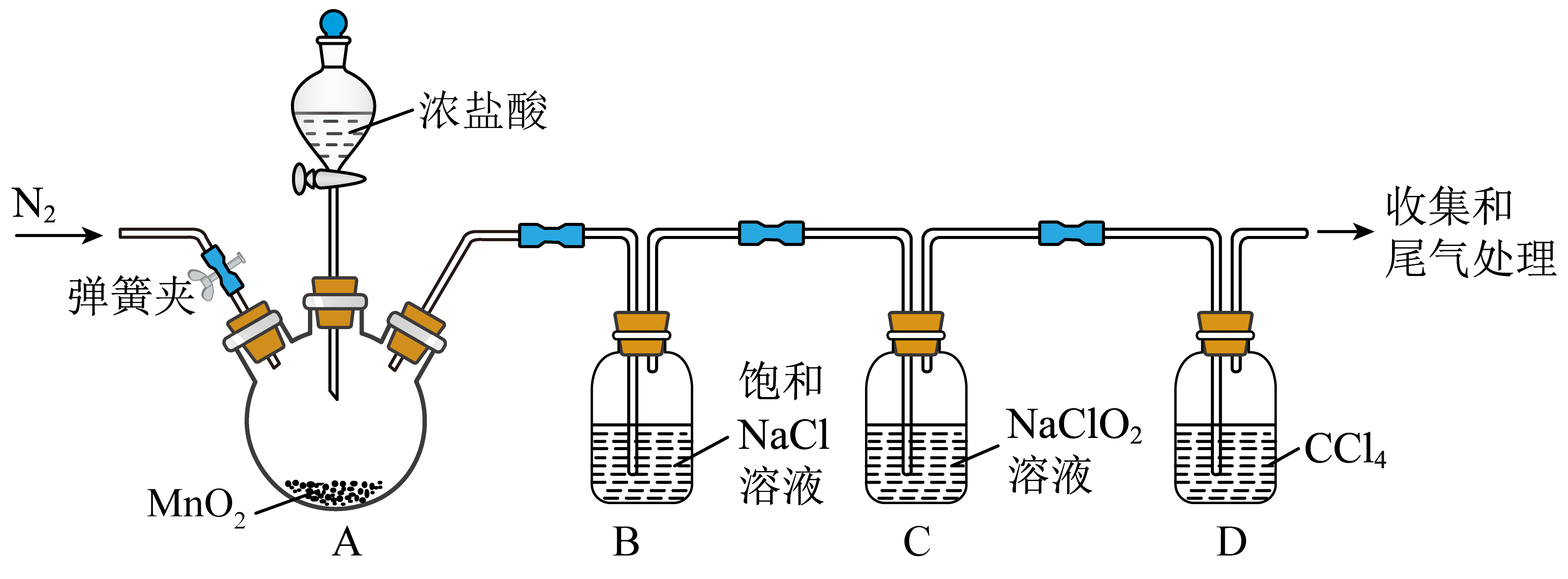
$\rm A$为$\rm Cl_{2}$发生装置$\rm ($夹持和加热装置已略$\rm )$。$\rm A$中反应的离子方程式为 。
$\\rm MnO_{2}+4H^{+}+2Cl^{-}\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array}Mn^{2+}+Cl_{2}↑+2H_{2}O$
"]]$\rm A$中二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,反应的离子方程式为$\rm MnO_{2}+4H^{+}+2Cl^{-}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array}Mn^{2+}+Cl_{2}↑+2H_{2}O$;
装置$\rm B$中饱和$\rm NaCl$溶液的作用是 。
除去氯气中的氯化氢
"]]装置$\rm B$中饱和$\rm NaCl$溶液的作用是除去氯气中的氯化氢;
装置$\rm C$中制备$\rm ClO_{2}$的反应为$\text{C}{{\text{l}}_{2}}+2\text{NaCl}{{\text{O}}_{2}}=2\text{NaCl}+2\text{Cl}{{\text{O}}_{2}}$,由此得到此条件下的氧化性:$\rm Cl_{2}$ $\rm ClO_{2}($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
$\\rm \\gt $
"]]氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则装置$\rm C$中制备$\rm ClO_{2}$的反应为$\rm Cl_{2}+2NaClO_{2}= 2NaCl+2ClO_{2}$,由此得到此条件下的氧化性:$\rm Cl_{2}\gt ClO_{2}$;
装置$\rm C$中$\rm Cl_{2}$还能发生的反应为 $\rm ($用化学方程式表示$\rm )$。
$\\rm Cl_{2}+H_{2}O\\rightleftharpoons \\rm HCl+HClO$
"]]装置$\rm C$中$\rm Cl_{2}$还能与水反应生成盐酸和次氯酸,其反应的化学方程式为$\rm Cl_{2}+H_{2}O\rightleftharpoons \rm HCl+HClO$;
随着装置$\rm A$中的$\rm Cl_{2}$持续产生,开始时装置$\rm D$液面上方出现黄绿色气体,溶液较长一段时间保持无色,随后逐渐变为黄绿色,说明有$\rm Cl_{2}$进入$\rm D$中。
[实验二:探究$\rm ClO_{2}$的性质]
将实验一中收集到的气体处理后得到纯净的$\rm ClO_{2}$,进行下表所示实验。
| 实验ⅰ | 将$\rm ClO_{2}$通入$\rm NaCl$溶液,溶液变为黄绿色、加入少量$\rm CCl_{4}$振荡,静置后溶液分层,上层溶液为黄绿色,下层溶液为无色。 |
| 实验ⅱ | 将$\rm ClO_{2}$通入$\rm HCl$溶液,溶液变为黄绿色。加入少量$\rm CCl_{4}$振荡,静置。溶液分层,上层溶液为浅黄绿色,下层溶液为黄绿色。 |
实验二中,证明$\rm ClO_{2}$能氧化$\text{C}{{\text{l}}^{-}}$产生$\rm Cl_{2}$的现象是 。
实验$\\rm ii$中,下层溶液为黄绿色
"]]实验二中,$\rm ClO_{2}$能氧化$\rm Cl^{-}$产生$\rm Cl_{2}$,氯气溶于四氯化碳中溶液为黄绿色,则证明$\rm ClO_{2}$能氧化$\rm Cl^{-}$产生$\rm Cl_{2}$的现象是实验$\rm ii$中,下层溶液为黄绿色;
由实验一、实验二得到的$\rm Cl_{2}$和$\rm ClO_{2}$氧化性强弱关系相反,可能的原因是 。
溶液的酸碱性不同
"]]由实验一、实验二得到的$\rm Cl_{2}$和$\rm ClO_{2}$氧化性强弱关系相反,可能的原因是溶液的酸碱性不同;
[实验反思]
甲同学从实验二推论实验一的装置$\rm D$中$\rm Cl_{2}$的来源:实验进行一段时间后,装置$\rm C$中的$\rm ClO_{2}$氧化$\text{C}{{\text{l}}^{-}}$,产生的$\rm Cl_{2}$进入装置$\rm D$。乙同学提出还有其他以下可能的来源。
来源$\rm 1$:部分$\rm Cl_{2}$未与$\rm C$中$\rm NaClO_{2}$反应就进入了装置$\rm D$。
来源$\rm 2$:$\rm Cl_{2}$通入装置$\rm C$中一段时间后, ,生成的$\rm Cl_{2}$进入了装置 $\rm D$。
溶液的酸性增强,发生反应$\\rm 8\\text{ClO}_{\\text{2}}^{-}\\rm +8H^{+}=6ClO_{2}↑+Cl_{2}↑+4H_{2}O$
"]]$\rm Cl_{2}$通入装置$\rm C$中一段时间后,溶液的酸性增强,发生反应$\rm 8\text{ClO}_{\text{2}}^{-}\rm +8H^{+}=6ClO_{2}↑+Cl_{2}↑+4H_{2}O$,生成的$\rm Cl_{2}$进入了装置$\rm D$。
高中 | 氯气题目答案及解析(完整版)
