高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
我国煤储量居世界第一,对煤的综合、高效、无害化利用是二十一世纪能源战略的重要组成部分,利用含铁元素的粉煤灰获得纳米$F{{e}_{2}}{{O}_{3}}$等重要物质的工艺流程如下。
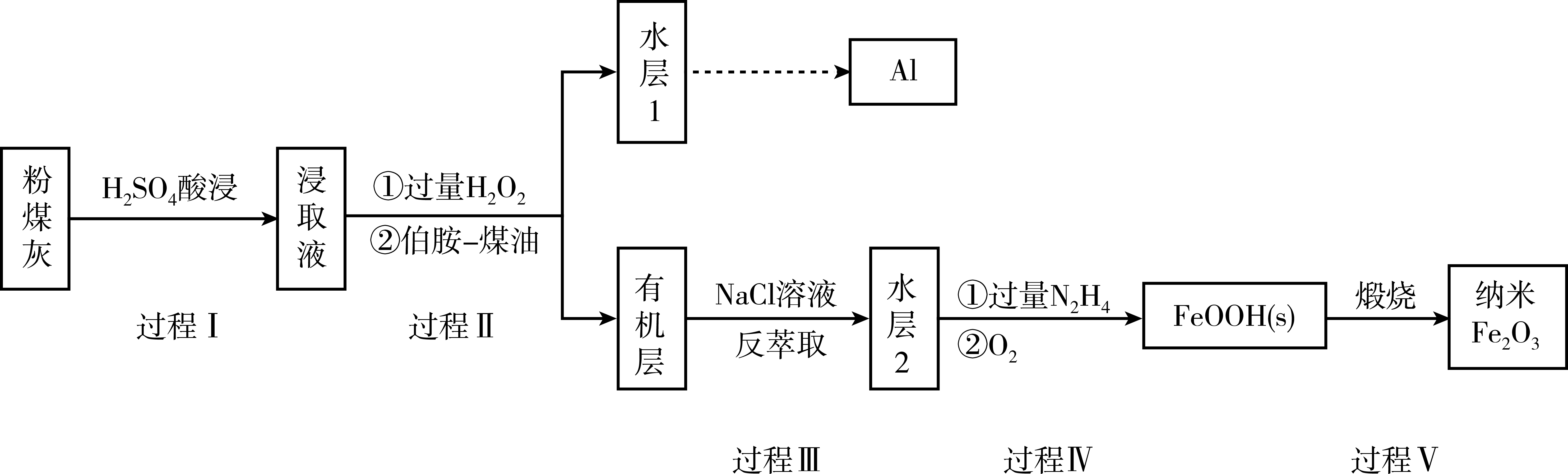 已知:$\rm i$:伯胺$\text{R-N}{{\text{H}}_{\text{2}}}$能与$\text{F}{{\text{e}}^{\text{3+}}}$反应:$\text{3R-N}{{\text{H}}_{\text{2}}}\text{+F}{{\text{e}}^{\text{3+}}}\text{+SO}_{4}^{2-}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{Fe}{{\left( \text{N}{{\text{H}}_{\text{2}}}\text{-R} \right)}_{\text{3}}}\text{(OH)S}{{\text{O}}_{\text{4}}}+{{\text{H}}^{+}}$生成易溶于煤油的产物。
已知:$\rm i$:伯胺$\text{R-N}{{\text{H}}_{\text{2}}}$能与$\text{F}{{\text{e}}^{\text{3+}}}$反应:$\text{3R-N}{{\text{H}}_{\text{2}}}\text{+F}{{\text{e}}^{\text{3+}}}\text{+SO}_{4}^{2-}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{Fe}{{\left( \text{N}{{\text{H}}_{\text{2}}}\text{-R} \right)}_{\text{3}}}\text{(OH)S}{{\text{O}}_{\text{4}}}+{{\text{H}}^{+}}$生成易溶于煤油的产物。
$\rm ii$:$\text{F}{{\text{e}}^{\text{3+}}}$在水溶液中易与$\text{C}{{\text{l}}^{-}}$反应:$\text{F}{{\text{e}}^{\text{3+}}}\text{+6C}{{\text{l}}^{-}}\rightleftharpoons {{\left[ \text{FeC}{{\text{l}}_{\text{6}}} \right]}^{\text{3-}}}$
写出过程$\rm I$中$\rm F{{e}_{2}}{{O}_{3}}$发生反应的离子方程式: 。
$\\rm \\text{F}{{\\text{e}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\text{+6}{{\\text{H}}^{+}}=\\text{2F}{{\\text{e}}^{\\text{3+}}}\\text{+3}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]过程$\rm I$中$\rm F{{e}_{2}}{{O}_{3}}$与稀硫酸反应,离子方程式为:$\rm \text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{+6}{{\text{H}}^{+}}=\text{2F}{{\text{e}}^{\text{3+}}}\text{+3}{{\text{H}}_{\text{2}}}\text{O}$;
过程Ⅱ加入过量${{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}$的作用是 。
将$\\text{F}{{\\text{e}}^{\\text{2+}}}$完全氧化为$\\text{F}{{\\text{e}}^{\\text{3+}}}$,有利于与伯胺反应,提高萃取率
"]]过程Ⅱ加入过量${{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}$的作用是:将$\text{F}{{\text{e}}^{\text{2+}}}$完全氧化为$\text{F}{{\text{e}}^{\text{3+}}}$,有利于与伯胺反应,提高萃取率;
过程Ⅱ加入伯胺$\rm -$煤油对浸取液进行分离,该操作的名称是 。
萃取、分液
"]]过程Ⅱ加入伯胺$\rm -$煤油对浸取液进行分离,该操作的名称是:萃取、分液;
从化学平衡角度解释过程Ⅱ利用$\text{NaCl}$溶液进行反萃取的原理: 。
$\\text{F}{{\\text{e}}^{\\text{3+}}}\\text{+6C}{{\\text{l}}^{-}}\\rightleftharpoons {{\\left[ \\text{FeC}{{\\text{l}}_{\\text{6}}} \\right]}^{\\text{3-}}}\\rm ($已知ⅱ中的反应$\\rm )$使$\\text{F}{{\\text{e}}^{\\text{3+}}}$浓度下降,$\\text{3R-N}{{\\text{H}}_{\\text{2}}}\\text{+F}{{\\text{e}}^{\\text{3+}}}\\text{+SO}_{\\text{4}}^{\\text{2-}}+{{\\text{H}}_{\\text{2}}}\\text{O}\\rightleftharpoons \\text{Fe}{{\\left( \\text{N}{{\\text{H}}_{\\text{2}}}\\text{-R} \\right)}_{\\text{3}}}\\text{(OH)S}{{\\text{O}}_{\\text{4}}}+{{\\text{H}}^{+}}\\rm ($已知$\\rm i$中的反应$\\rm )$平衡向逆反应方向移动,$\\text{F}{{\\text{e}}^{\\text{3+}}}$从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取
"]]$\text{F}{{\text{e}}^{\text{3+}}}\text{+6C}{{\text{l}}^{-}}\rightleftharpoons {{\left[ \text{FeC}{{\text{l}}_{\text{6}}} \right]}^{\text{3-}}}\rm ($已知ⅱ中的反应$\rm )$使$\text{F}{{\text{e}}^{\text{3+}}}$浓度下降,$\text{3R-N}{{\text{H}}_{\text{2}}}\text{+F}{{\text{e}}^{\text{3+}}}\text{+SO}_{\text{4}}^{\text{2-}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{Fe}{{\left( \text{N}{{\text{H}}_{\text{2}}}\text{-R} \right)}_{\text{3}}}\text{(OH)S}{{\text{O}}_{\text{4}}}+{{\text{H}}^{+}}\rm ($已知$\rm i$中的反应$\rm )$平衡向逆反应方向移动,$\text{F}{{\text{e}}^{\text{3+}}}$从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取;
${{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}$具有碱性,可与${{\text{H}}^{+}}$结合生成${{\text{N}}_{\text{2}}}\text{H}_{5}^{+}$,其中氮原子的杂化类型为 从结构角度分析,它比$\text{N}{{\text{H}}_{\text{3}}}$配位能力 $\rm ($“强”或“弱”$\rm )$,过程Ⅳ中先用过量的${{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}$将水层$\rm 2$中$\text{F}{{\text{e}}^{\text{3+}}}$转化为$\text{F}{{\text{e}}^{\text{2+}}}$并生成${{\text{N}}_{\text{2}}}$,反应的离子方程式为 ,得到的$\text{F}{{\text{e}}^{\text{2+}}}$再被${{\text{O}}_{\text{2}}}$氧化为$\text{FeOOH}$。
$\\text{s}{{\\text{p}}^{\\text{3}}}$ ; 弱 ; $\\text{4F}{{\\text{e}}^{\\text{3+}}}\\text{+5}{{\\text{N}}_{\\text{2}}}{{\\text{H}}_{\\text{4}}}=\\text{4F}{{\\text{e}}^{\\text{2+}}}+{{\\text{N}}_{\\text{2}}}\\text{+4}{{\\text{N}}_{\\text{2}}}\\text{H}_{\\text{5}}^{+}$
"]]${{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}$具有碱性,和$\text{N}{{\text{H}}_{\text{3}}}$一样,可以看成是$\text{N}{{\text{H}}_{\text{3}}}$中的$\rm H$原子被$\rm N$原子取代,所以${{\text{N}}_{\text{2}}}\text{H}_{5}^{+}$中氮原子的杂化类型为$\text{s}{{\text{p}}^{\text{3}}}$;因为${{\text{N}}_{\text{2}}}\text{H}_{5}^{+}$的配位体$\rm N$原子负电荷较大,空间位阻较大,配位能力较弱;过程Ⅳ中先用过量的${{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}$将水层$\rm 2$中$\text{F}{{\text{e}}^{\text{3+}}}$转化为$\text{F}{{\text{e}}^{\text{2+}}}$并生成${{\text{N}}_{\text{2}}}$,反应的离子方程式为:$\text{4F}{{\text{e}}^{\text{3+}}}\text{+5}{{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}=\text{4F}{{\text{e}}^{\text{2+}}}+{{\text{N}}_{\text{2}}}\text{+4}{{\text{N}}_{\text{2}}}\text{H}_{\text{5}}^{+}$;
以$\text{NaClO}$溶液作为吸收剂对燃煤烟气进行一体化“脱硫”、“脱硝”。控制溶液的$\text{pH=5}\text{.5}$,将烟气中的$\text{S}{{\text{O}}_{\text{2}}}$、$\text{NO}$转化为$\text{SO}_{4}^{2-}$、$\text{NO}_{\text{3}}^{-}$,均为放热反应。
①一定时间内,温度对硫、硝脱除率的影响曲线如下图,$\text{S}{{\text{O}}_{\text{2}}}$的脱除率高于$\text{NO}$,可能的原因是 $\rm ($写出$\rm 1$种即可$\rm )$。
②烟气中$\text{S}{{\text{O}}_{\text{2}}}$和$\text{NO}$的体积比为$\text{4:1}$,$\text{50}\ {}^\circ \text{C}$时的脱除率见图,则此吸收液中烟气转化生成的$\text{NO}_{\text{3}}^{-}$和$\text{C}{{\text{l}}^{-}}$的物质的量之比为 。
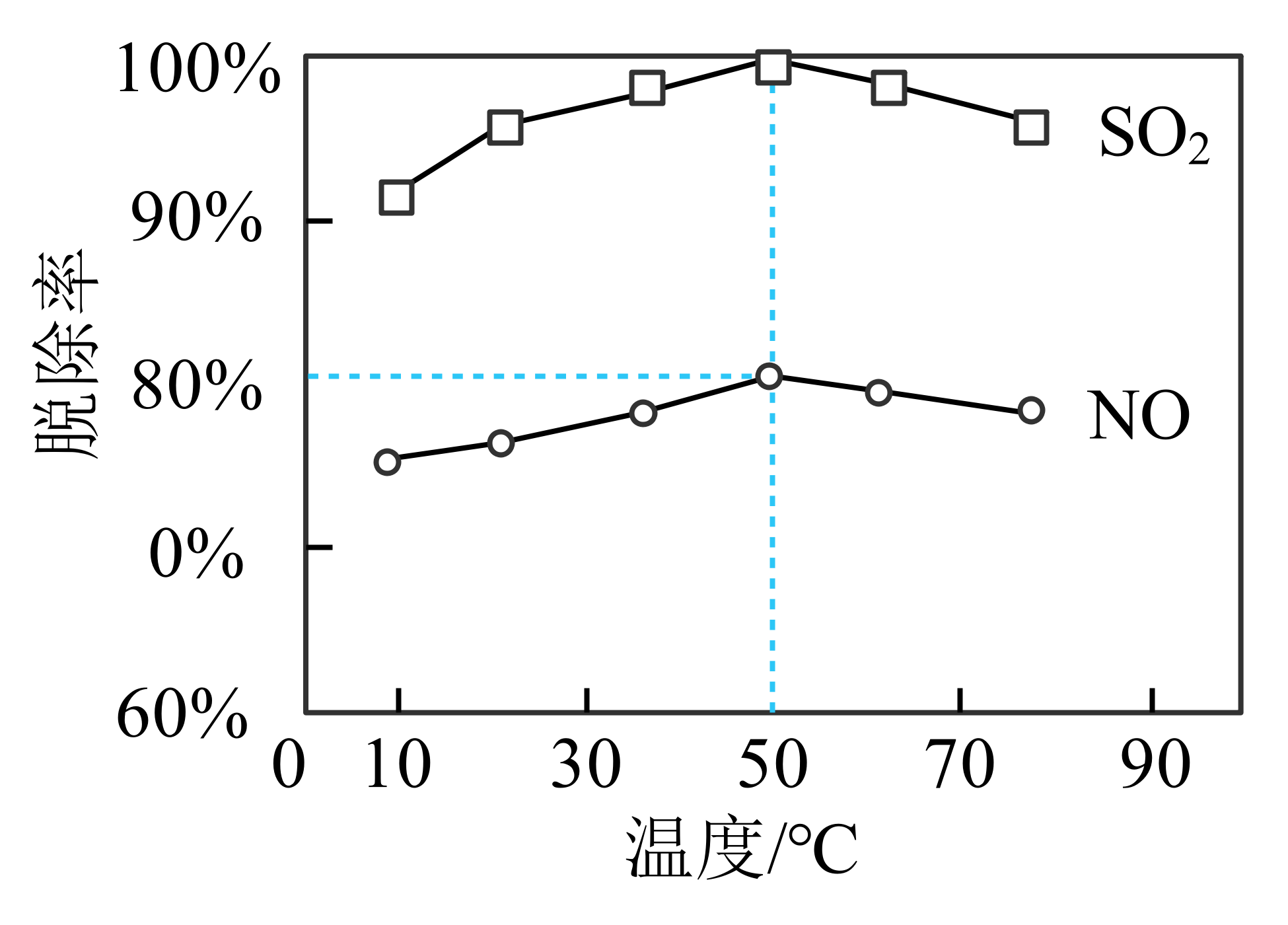
$\\text{S}{{\\text{O}}_{\\text{2}}}$在水中的溶解度大于$\\text{NO}$;$\\text{S}{{\\text{O}}_{\\text{2}}}$在溶液中的还原性强于$\\text{NO}$;$\\text{S}{{\\text{O}}_{\\text{2}}}$与$\\text{NaClO}$溶液的反应速率大于$\\text{NO}$ ; $\\text{2}:\\text{13}$
"]]根据如图所示的信息,$\text{S}{{\text{O}}_{\text{2}}}$的脱除率高于$\text{NO}$,可能的原因是:$\text{S}{{\text{O}}_{\text{2}}}$在水中的溶解度大于$\text{NO}$或者$\text{S}{{\text{O}}_{\text{2}}}$在溶液中的还原性强于$\text{NO}$或者$\text{S}{{\text{O}}_{\text{2}}}$与$\text{NaClO}$溶液的反应速率大于$\text{NO}$;烟气中$\text{S}{{\text{O}}_{\text{2}}}$和$\text{NO}$的体积比为$\text{4:1}$,假设$\text{S}{{\text{O}}_{\text{2}}}$和$\text{NO}$物质的量分别为$\rm 4$ $\rm mol$和$\rm 1$ $\rm mol$,由于$\text{50}\ {}^\circ \text{C}$时的脱除率为$100\%$,脱硫的反应为:$\text{S}{{\text{O}}_{\text{2}}}\text{+Cl}{{\text{O}}^{-}}+{{\text{H}}_{\text{2}}}\text{O=SO}_{\text{4}}^{\text{2-}}\text{+C}{{\text{l}}^{-}}\text{+2}{{\text{H}}^{+}}$,$\rm 4$ $\rm mol$ $\text{S}{{\text{O}}_{\text{2}}}$转化$\rm 8$ $\rm mol$电子,硝的脱除率为$80\%$,$\rm 1$ $\rm mol$ $\text{NO}$转化为$\text{NO}_{3}^{-}$转移的电子数为:$1\times 80\%\times 3=2.4$ $\rm mol$,转移的电子总数为:$8+2.4=10.4\text{ mol}$,根据得失电子守恒,脱硫和脱硝的过程中$\text{Cl}{{\text{O}}^{-}}$转化为$\text{C}{{\text{l}}^{-}}$,每生成$\rm 1$ $\rm mol$ $\text{C}{{\text{l}}^{-}}$,转移$\rm 2$ $\rm mol$电子,所以生成的$\text{C}{{\text{l}}^{-}}$物质的量为:$\dfrac{10.4}{2}=5.2\text{ mol}$,所以$n\text{(NO}_{\text{3}}^{-}\text{)}:n\text{(C}{{\text{l}}^{-}}\text{)}=0.8:5.2=2:13$。
高中 | 杂化轨道理论题目答案及解析(完整版)
