高中 | 摩尔质量 题目答案及解析
稿件来源:高途
高中 | 摩尔质量题目答案及解析如下,仅供参考!
必修一
第一章 从实验学化学
第二节 化学计量在实验中的应用
摩尔质量
铝元素是地壳中含量最多的金属元素,常以化合态的形式存在于铝土矿中,其氧化物具有两性,$\rm Cr_{2}O_{3}$与$\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$类似。
Ⅰ.工业上常常从铝土矿$\rm ($主要成分为$\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$,含$\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$、$\text{Si}{{\text{O}}_{\text{2}}}$杂质$\rm )$中提取$\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$,并通过电解法制备铝单质。请根据流程图,回答相关问题。
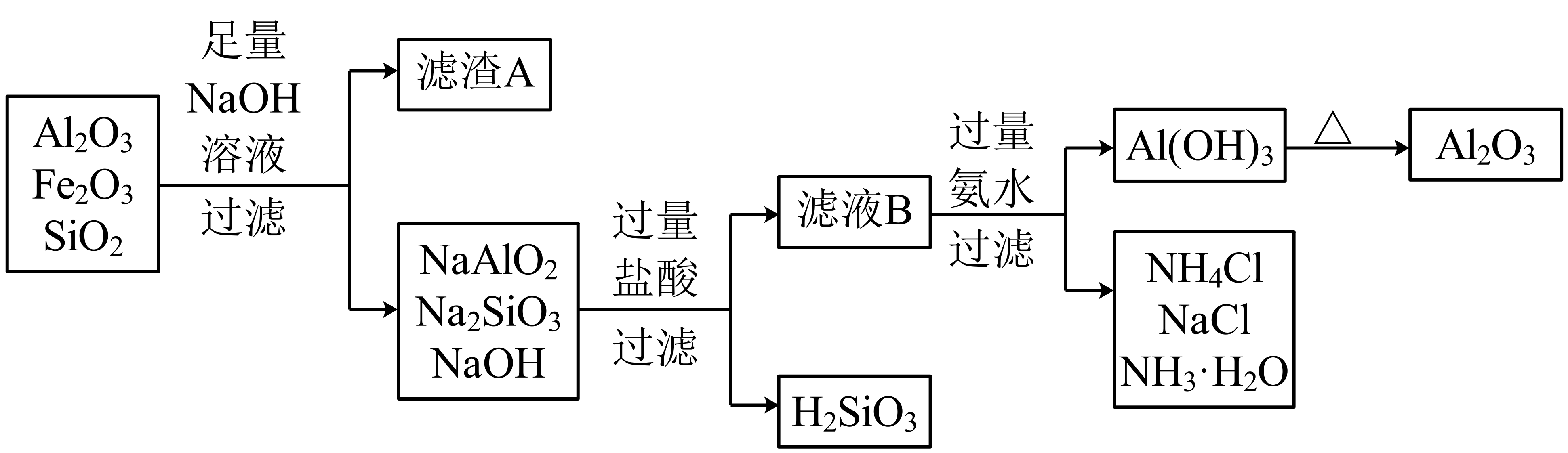
已知:$\text{Al}{{\left( \text{OH} \right)}_{\text{3}}}$属于两性氢氧化物,既能溶于稀盐酸又能溶于$\rm NaOH$溶液。
写出“滤渣$\rm A$”的化学式: ,“滤液$\rm B$”中的溶质为 $\rm ($写化学式$\rm )$
$\\rm Fe_{2}O_{3}$ ; $\\rm AlCl_{3}$,$\\rm NaCl$,$\\rm HCl$
"]]“滤渣$\rm A$”的化学式:$\rm Fe_{2}O_{3}$,“滤液$\rm B$”中的溶质为$\rm AlCl_{3}$,$\rm NaCl$,$\rm HCl$,故答案为:$\rm Fe_{2}O_{3}$;$\rm AlCl_{3}$,$\rm NaCl$,$\rm HCl$;
上述流程中“过量氨水”能否改为“过量$\rm NaOH$溶液”? $\rm ($填“能”或“不能”$\rm )$,请用离子方程式解释: 。
不能 ; $\\text{A}{{\\text{l}}^{\\text{3+}}}\\text{+4O}{{\\text{H}}^{-}}\\text{=AlO}_{\\text{2}}^{-}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O}$或$\\text{Al}{{\\left( \\text{OH} \\right)}_{\\text{3}}}\\text{+O}{{\\text{H}}^{-}}\\text{=AlO}_{\\text{2}}^{-}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]上述流程中“过量氨水”不能改为“过量$\rm NaOH$溶液”,氢氧化铝溶于强碱,用离子方程式解释:$\text{A}{{\text{l}}^{\text{3+}}}\text{+4O}{{\text{H}}^{-}}\text{=AlO}_{\text{2}}^{-}\text{+2}{{\text{H}}_{\text{2}}}\text{O}$或$\text{Al}{{\left( \text{OH} \right)}_{\text{3}}}\text{+O}{{\text{H}}^{-}}\text{=AlO}_{\text{2}}^{-}\text{+2}{{\text{H}}_{\text{2}}}\text{O}$。
Ⅱ. 已知$\rm Cr_{2}O_{3}$能与$\rm NaOH$溶液反应生成亚铬酸钠$\rm (NaCrO_{2})$,$\rm Cr_{2}O_{3}$可由${{\text{K}}_{\text{2}}}\text{C}{{\text{r}}_{\text{2}}}{{\text{O}}_{\text{7}}}$和硫黄$\rm (S)$混合后进行反应得到,发生反应的化学方程式为$\rm K_{2}Cr_{2}O_{7}+S=K_{2}SO_{4}+Cr_{2}O_{3}$,再经湿磨、热水洗涤、压滤、干燥、粉碎制得。
写出$\rm Cr_{2}O_{3}$与$\rm NaOH$溶液反应的化学方程式 。
$\\rm Cr_{2}O_{3}+2NaOH=2NaCrO_{2}+H_{2}O$
"]]$\rm Cr_{2}O_{3}$能与$\rm NaOH$溶液反应生成亚铬酸钠$\rm (NaCrO_{2})$,$\rm Cr_{2}O_{3}$与$\rm NaOH$溶液反应的化学方程式$\rm Cr_{2}O_{3}+2NaOH=2NaCrO_{2}+H_{2}O$。
由${{\text{K}}_{\text{2}}}\text{C}{{\text{r}}_{\text{2}}}{{\text{O}}_{\text{7}}}$和硫黄制取$\rm Cr_{2}O_{3}$的废水中含有一定量的$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$,$\rm Cr$元素含量达标才能排放,可以加入$\rm FeSO_{4}$溶液去除酸性废水中的$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$,使$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$转化为$\text{C}{{\text{r}}^{\text{3+}}}$而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放,上述过程$\rm FeSO_{4}$溶液与$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$发生的反应中氧化剂与还原剂的物质的量之比为 。
$\\rm 1$∶$\\rm 6$
"]]酸性废水中$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$还原为$\rm Cr^{3+}$,同时$\rm Fe^{2+}$被氧化生成铁离子,反应的离子方程式为$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}\rm +6Fe^{2+}+14H^{+}=2Cr^{3+}+6Fe^{3+}+7H_{2}O$,上述过程$\rm FeSO_{4}$溶液与$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$发生的反应中氧化剂$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$与还原剂$\rm Fe^{2+}$的物质的量之比为$\rm 1$∶$\rm 6$。
某兴趣小组同学想根据上述反应原理测出该酸性废水中残留的$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$的物质的量浓度,采样后,经初步预算需要$\rm 0.1$ $\rm mol/L$的$\rm FeSO_{4}$溶液$\rm 480$ $\rm mL$,配制该溶液时至少需称量 $\rm g$ $\rm FeSO_{4}·7H_{2}O$。
$\\rm 13.9$
"]]需要$\rm 0.1$ $\rm mol/L$的$\rm FeSO_{4}$溶液$\rm 480$ $\rm mL$,应配制$\rm 500$ $\rm mL$溶液,配制该溶液时至少需称量$\rm 0.1$ $\rm mol/L\times 0.5$ $\rm L\times 278$ $\rm g/mol=13.9$ $\rm g$ $\rm FeSO_{4}·7H_{2}O$。
高中 | 摩尔质量题目答案及解析(完整版)
