高中 | 氧化还原反应的计算 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应的计算题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的计算
将一定量的$\text{C}{{\text{l}}_{2}}$通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成物中有三种含氯元素的离子,其中$\text{Cl}{{\text{O}}^{-}}$和$\text{ClO}_{\text{3}}^{-}$两种离子的物质的量$ (n\rm )$与反应时间$ (t\rm )$的变化示意图如图所示。下列说法正确的是$(\quad\ \ \ \ )$
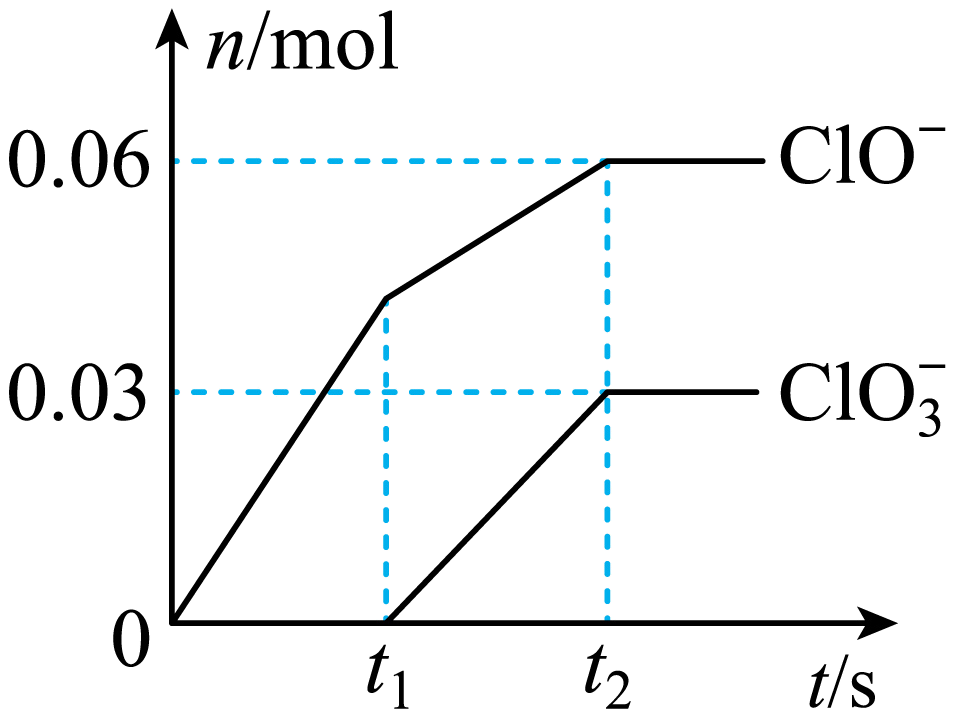
苛性钾溶液中$\\text{KOH}$的质量是$4.94\\ \\text{g}$
","氧化产物与还原产物的物质的量之比是$\\rm 7$:$\\rm 3$
","反应中转移电子的物质的量是$0.09\\ \\text{mol}$
","在${{t}_{1}}$前后产物不同的主要原因可能是$\\text{C}{{\\text{l}}_{2}}$与$\\text{KOH}$反应放热
"]分析:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图知$n\left( \text{Cl}{{\text{O}}^{-}} \right)=0.06\,\text{mol}$, $n(\text{ClO}_{\text{3}}^{-})=0.03\,\text{mol}$,根据电子转移守恒可知生成的氯离子$n\left( \text{C}{{\text{l}}^{-}} \right)=0.06\,\text{mol}\times \left( 1-0 \right)+0.03\,\text{mol}\times \left( 5-0 \right)=0.21\,\text{mol}$,故转移电子物质的量为$\rm 0.21$ $\rm mol$,根据电荷守恒可知$n\left( {{\text{K}}^{+}} \right)=n\left( \text{C}{{\text{l}}^{-}} \right)+n\left( \text{Cl}{{\text{O}}^{-}} \right)+n(\text{ClO}_{\text{3}}^{-})=0.21\,\text{mol}+0.06\,\text{mol}+0.03\,\text{mol}=0.3\,\text{mol}$;
$\rm A$.通过以上分析可知,氢氧化钾的物质的量为$\rm 0.3$ $\rm mol$,则氢氧化钾质量$\rm 0.3$ $\rm mol\times 56$ $\rm g/mol=16.8$ $\rm g$,故$\rm A$错误;
$\rm B$.氧化产物$\rm (ClO^{-}$、$\text{ClO}_{\text{3}}^{-}\rm )$与还原产物$\rm (Cl^{-})$的物质的量之比是$\rm (0.06+0.03):0.21=3:7$,故$\rm B$错误;
$\rm C$.通过以上分析可知,转移电子物质的量为$\rm 0.21$ $\rm mol$,故$\rm C$错误;
$\rm D$.据图知,氯气和氢氧化钾先生成次氯酸钾,${{t}_{1}}$后开始生成氯酸钾,说明氯气和氢氧化钾的反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以${{t}_{1}}$前后产物不同的主要原因可能是$\text{C}{{\text{l}}_{2}}$与$\text{KOH}$反应放热,故$\rm D$正确;
故选:$\rm D$
高中 | 氧化还原反应的计算题目答案及解析(完整版)
