| 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
| 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
以铁菱镁矿$\rm ($主要成分是$\text{MgC}{{\text{O}}_{3}}$,还含有$\text{CaC}{{\text{O}}_{3}}$,$\text{FeC}{{\text{O}}_{3}}\rm )$为原料制备$\text{MgS}{{\text{O}}_{4}}\cdot {{\text{H}}_{2}}\text{O}$的工艺流程如图所示,下列关于该工艺流程的说法错误的是$(\quad\ \ \ \ )$
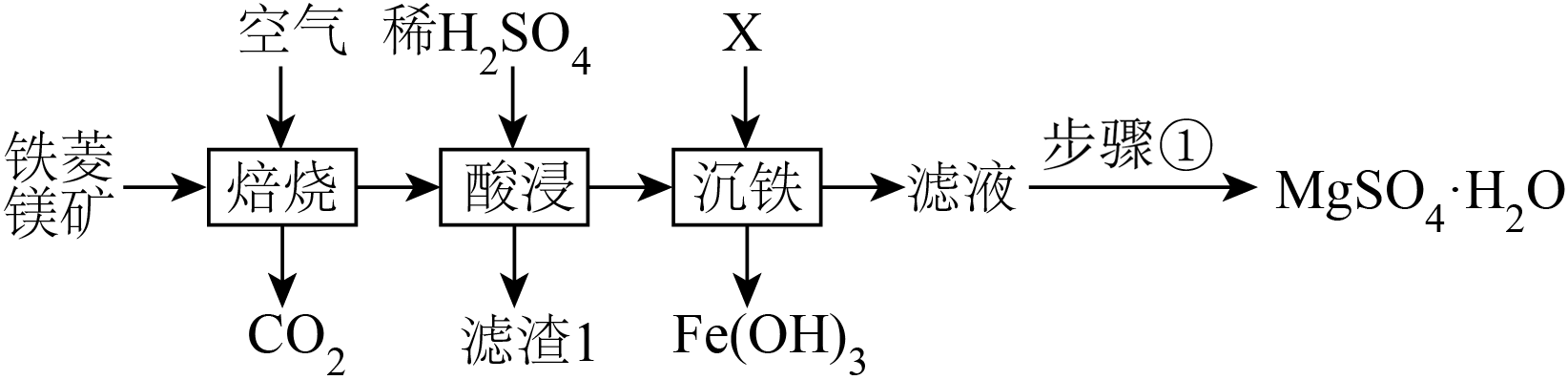
滤渣$\\rm 1$的主要成分为$\\mathrm{CaSO}_4$
","$\\rm X$为过量的$\\text{NaOH}$溶液
","“焙烧”过程,$\\text{FeC}{{\\text{O}}_{3}}$与空气反应的化学方程式为$4\\text{FeC}{{\\text{O}}_{3}}+{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}2\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}+4\\text{C}{{\\text{O}}_{2}}$
","步骤①的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
"]分析:由流程可知,铁菱镁矿通入空气煅烧,得到$\rm MgO$、$\rm CaO$、$\rm Fe_{2}O_{3}$,加稀硫酸时$\rm MgO$、$\rm Fe_{2}O_{3}$溶解得到$\rm MgSO_{4}$和$\rm Fe_{2}(SO_{4})_{3}$的混合溶液,过滤,滤渣为$\rm CaSO_{4}$,再加$\rm X$调$\rm pH$使$\rm Fe^{3+}$完全沉淀,过滤分离掉氢氧化铁,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到$\rm MgSO_{4}·H_{2}O$,以此来解答;
$\rm A$.由分析可知,滤渣$\rm 1$的主要成分为$\rm CaSO_{4}$,$\rm A$正确;
$\rm B$.$\rm X$选择$\rm NaOH$溶液会引入新杂质,可选择$\rm MgO$,$\rm B$错误;
$\rm C$.“焙烧”过程,$\rm FeCO_{3}$与空气中氧气发生氧化还原反应,铁元素化合价升高生成氧化铁,化学方程式为$4\text{FeC}{{\text{O}}_{3}}+{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}2\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}+4\text{C}{{\text{O}}_{2}}$,$\rm C$正确;
$\rm D$.步骤①将硫酸镁溶液转化为$\text{MgS}{{\text{O}}_{4}}\cdot {{\text{H}}_{2}}\text{O}$,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,$\rm D$正确;
故选:$\rm B$
| 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
