高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
利用物质的结构与性质进行研究,有助于我们更好地掌握知识。
基态砷原子中,共有 种空间运动状态不同的电子。
$\\rm 18$
"]]基态$\rm As$原子的核外电子排布式为:$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^{2}4p^{3}$,共有$\rm 18$个原子轨道。
$\text{H-N-H}$键角大小:${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$ $\text{N}{{\text{H}}_{\text{3}}}\rm ($填“$\rm \gt $”、“$\rm =$”或“$\rm \lt $”$\rm )$,其原因是 。
$\\rm \\gt $ ; ${{\\left[ \\text{Cu}{{\\left( \\text{N}{{\\text{H}}_{\\text{3}}} \\right)}_{\\text{4}}} \\right]}^{\\text{2+}}}$中的$\\rm N$原子的价层电子对均为成键电子对,而$\\text{N}{{\\text{H}}_{\\text{3}}}$中的$\\rm N$原子存在一对孤电子对,孤电子对与成键电子对的斥力比成键电子对之间的斥力更大,所以$\\text{N}{{\\text{H}}_{\\text{3}}}$中的键角更小
"]]$\text{N}{{\text{H}}_{\text{3}}}$中的$\rm N$原子存在的孤电子对数为$\dfrac{5-1\times 3}{2}=1$,价层电子对数$\rm =1+3=4$,氨分子为三角锥结构,${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中的$\rm N$原子形成$\rm 3$个普通的$\rm N-H$,还有$\rm 1$个配位键,价层电子对数为$\rm 4$,且均为成键电子对,氨分子为三角锥结构,则$\text{H-N-H}$键角大小:${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}\rm \gt \text{N}{{\text{H}}_{\text{3}}}$,因为${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中的$\rm N$原子的价层电子对均为成键电子对,而$\text{N}{{\text{H}}_{\text{3}}}$中的$\rm N$原子存在一对孤电子对,孤电子对与成键电子对的斥力比成键电子对之间的斥力更大,所以$\text{N}{{\text{H}}_{\text{3}}}$中的键角更小。
有关$\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]\text{S}{{\text{O}}_{\text{4}}}\cdot {{\text{H}}_{\text{2}}}\text{O}$晶体的下列说法正确的是 。
$\rm A$.超分子都是通过配位键相互作用形成的
$\rm B$.$\text{Cu}$的焰色试验呈绿色,是电子由激发态跃迁至基态时吸收能量产生的
$\rm C$.$\text{1}\,\text{mol}\,{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中含有$\sigma$键的数目为${16}{{N}_{\text{A}}}$
$\rm D$.对该晶体进行加热时,配体$\text{N}{{\text{H}}_{\text{3}}}$比${{\text{H}}_{\text{2}}}\text{O}$更容易失去
$\\rm C$
"]]$\rm A$.超分子是两种或两种以上的分子通过分子间相互作用形成的分子聚合体。超分子定义中的分子是广义的,包括离子。分子以什么样的作用形成超分子?说法很纷繁,有人将它概括为非共价键,有人则将其限于分子间作用力。超分子这种分子集合体,有的是有限的,有的是无限伸展的。故超分子不可能都是通过配位键相互作用形成的,$\rm A$错误;
$\rm B$.$\text{Cu}$的焰色试验呈绿色,是电子由激发态跃迁至基态或者能量更低的激发态时释放能量产生的,$\rm B$错误;
$\rm C$.${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中的每个$\rm N$原子形成$\rm 3$个普通的$\rm N-H$,还有$\rm 1$个配位键,都是$\sigma$键,故$\rm 1$个${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中含有$\rm 4\times 4=16$个$\sigma$键,键的数目为$\text{1}\,\text{mol}\,{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{\text{4}}} \right]}^{\text{2+}}}$中含有$\sigma$键的数目为${16}{{{N}}_{\text{A}}}$,$\rm C$正确;
$\rm D$.对该晶体进行加热时,先失结晶水,内界的氨气不易失去,$\rm D$错误;
配合物$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$是一种具有三角双锥结构的黄色黏稠状液体,可用于制备纯铁,结构如图所示。已知熔点为$-20\text{ }{}^\circ \text{C}$,沸点为$103\text{ }{}^\circ \text{C}$。下列关于$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$的说法错误的是 。
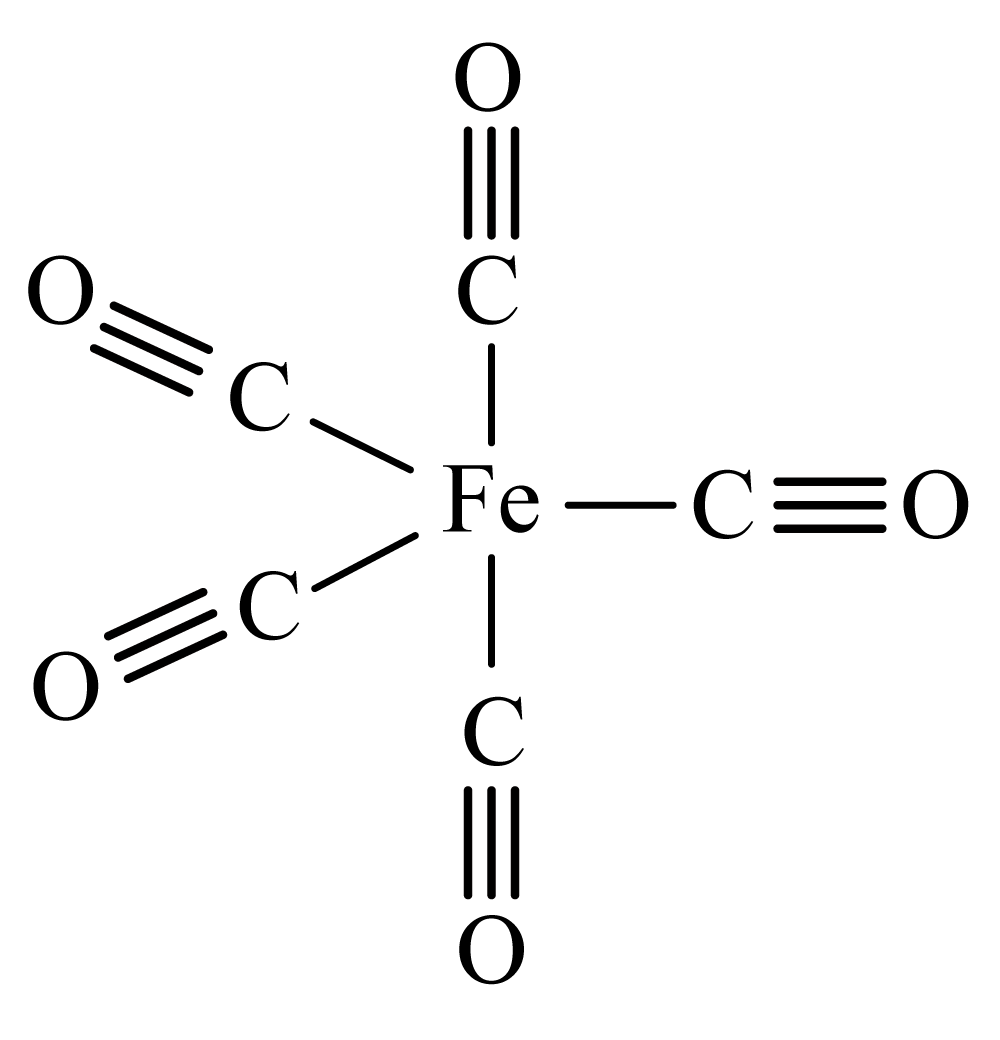
$\rm A$.$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$中$\text{Fe}$原子以$\text{s}{{\text{p}}^{\text{3}}}$杂化方式与$\text{CO}$成键
$\rm B$.五羰基铁不溶于水,易溶于苯
$\rm C$.固体$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$属于分子晶体
$\rm D$.每个$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$粒子中含配位键的个数为$\rm 10$
$\\rm A$
"]]$\rm A$.由图可知,一氧化碳分子中的碳原子提供孤电子对,铁原子提供空轨道,则每个$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$粒子中含$\rm Fe-C$配位键的个数为$\rm 5$,则$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$中$\text{Fe}$原子有$\rm 5$个杂化轨道,不可能以$\text{s}{{\text{p}}^{\text{3}}}$杂化方式与$\text{CO}$成键,具有三角双锥结构,为$\rm sp^{3}d$杂化,$\rm A$错误;
$\rm B$.已知配合物$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$熔点为$-20\text{ }{}^\circ \text{C}$,沸点为$103\text{ }{}^\circ \text{C}$,则固体$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$属于分子晶体,按相似相溶原理,五羰基铁不溶于水,易溶于苯,$\rm B$正确;
$\rm C$.已知配合物$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$熔点为$-20\text{ }{}^\circ \text{C}$,沸点为$103\text{ }{}^\circ \text{C}$,则固体$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$属于分子晶体,$\rm C$正确;
$\rm D$.由图可知,一氧化碳分子中的碳原子提供孤电子对,铁原子提供空轨道,则每个$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$粒子中含$\rm 5$个$\rm Fe-C$配位键,每个一氧化碳分子内,氧和碳原子间还有$\rm 1$个配位键,则每个$[\!\!\text{ Fe(C}{{\text{O}}_{5}}]$粒子中含配位键的个数为$\rm 10$,$\rm D$正确;
从磷钇矿中可提取稀土元素钇$\rm (Y)$,某磷钇矿的结构如图。
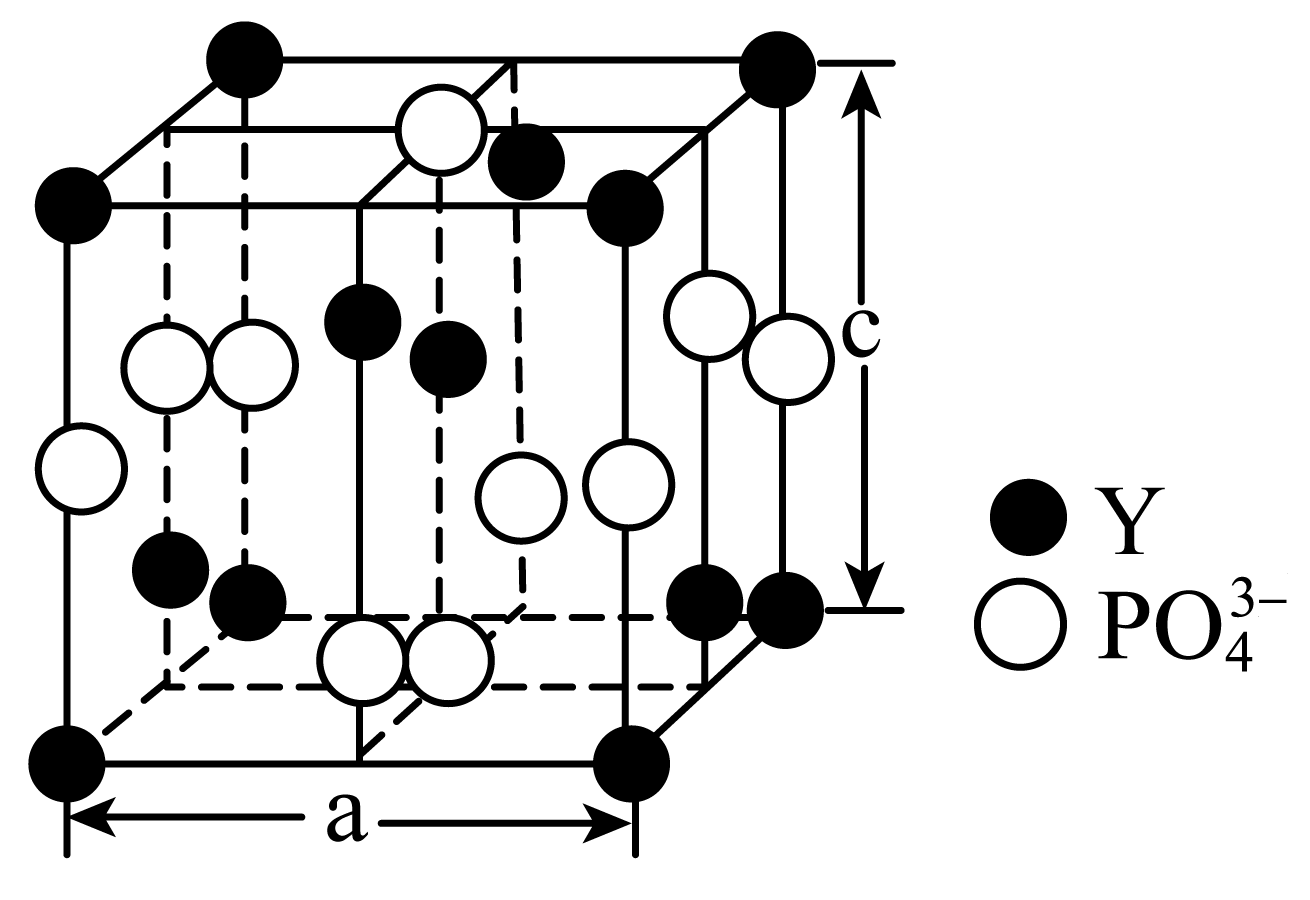
该磷钇矿的化学式为 。
$\\text{YP}{{\\text{O}}_{\\text{4}}}$
"]]晶胞中含$\rm Y$的个数是:$8\times \dfrac{1}{8}+4\times \dfrac{1}{2}+1=4$,含磷酸根的个数是:$6 \times \dfrac{1}{2}+4 \times \dfrac{1}{4}=4$,二者的个数比是$\rm 1:1$。
高中 | 杂化轨道理论题目答案及解析(完整版)
