高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
在“碳达峰、碳中和”的大背景下,实现$\text{C}{{\text{O}}_{2}}$的有效转化成为科研工作者的研究热点,以下是几种常见的$\text{C}{{\text{O}}_{2}}$利用方法:
$\rm I$.以$\text{I}{{\text{n}}_{2}}{{\text{O}}_{3}}$作催化剂,可使$\text{C}{{\text{O}}_{2}}$在温和条件下转化为甲醇,反应经历如下过程:
$\rm i.$催化剂活化:$\operatorname{In}_2 \mathrm{O}_3\rm ($无活性$ ) \overset{还原 }{\underset{ 氧化}{\rightleftharpoons}} \text{l}{{\text{n}}_{\text{2}}}{{\text{O}}_{ {3-x}}}\rm ($有活性$\rm )$;
$\rm ii.\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$在活化的催化剂表面发生反应①:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta{{ {H}}_{\text{1}}}$,同时也有反应②:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta{{ {H}}_{\text{2}}}$等副反应发生。
反应①中碳原子的杂化方式变化情况为 。
$\\text{sp}\\xrightarrow{{}}\\text{s}{{\\text{p}}^{\\text{3}}}$
"]]$\rm CO_{2}$中$\rm C$原子形成$\rm 2$个$\rm \sigma$键,无孤电子对,所以价电子对数为$\rm 2$,$\rm C$原子杂化方式为$\rm sp$,甲醇中$\rm C$原子形成$\rm 4$个$\rm \sigma$键,无孤电子对,所以价电子对数为$\rm 4$,$\rm C$原子杂化方式为$\rm sp^{3}$,反应①中碳原子的杂化方式变化情况为$\text{sp}\xrightarrow{{}}\text{s}{{\text{p}}^{\text{3}}}$;
某温度下,在恒容反应器中,能说明反应①达到平衡状态的是$(\quad\ \ \ \ )\rm ($填序号$\rm )$。
$v\\left(\\mathrm{H}_2\\right)=3 v\\left(\\mathrm{CH}_3 \\mathrm{OH}\\right)$
","混合气体的平均摩尔质量不变
","混合气体的密度不变
","$\\text{C}{{\\text{H}}_{3}}\\text{OH}\\left( \\text{g} \\right)$和${{\\text{H}}_{2}}\\text{O}\\left( \\text{g} \\right)$的分压相等
"]$\rm A$.$v\left(\mathrm{H}_2\right)=3 v\left(\mathrm{CH}_3 \mathrm{OH}\right)$,不能判断正逆反应速率比等于系数比,反应不一定平衡,故不选$\rm A$;
$\rm B$.反应前后气体总质量不变、气体总物质的量是变量,混合气体的平均摩尔质量是变量,若混合气体的平均摩尔质量不变,反应一定达到平衡状态,故选:$\rm B$;
$\rm C$.反应前后气体总质量不变、容器体积不变,混合气体的密度是恒量,混合气体的密度不变,反应不一定平衡,故不选$\rm C$;
$\rm D$.$\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)$和${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$都是生成物,物质的量比始终为$\rm 1:1$,所以$\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)$和${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$的分压始终相等,故反应不一定平衡,故不选$\rm D$;
选$\rm B$。
某温度下,$\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$的混合气体以不同流速通过恒容反应器,气体流速与$\text{C}{{\text{O}}_{2}}$转化率、$\text{C}{{\text{H}}_{3}}\text{OH}$选择性的关系如图,$\rm ($已知:$\text{C}{{\text{H}}_{3}}\text{OH}$选择性$=\dfrac{生成\text{C}{{\text{H}}_{3}}\text{OH}所消耗\text{C}{{\text{O}}_{2}}的物质的量}{发生转化的\text{C}{{\text{O}}_{2}}的物质的量}\times 100\% )\text{C}{{\text{H}}_{3}}\text{OH}$选择性随气体流速增大而升高的原因可能有:
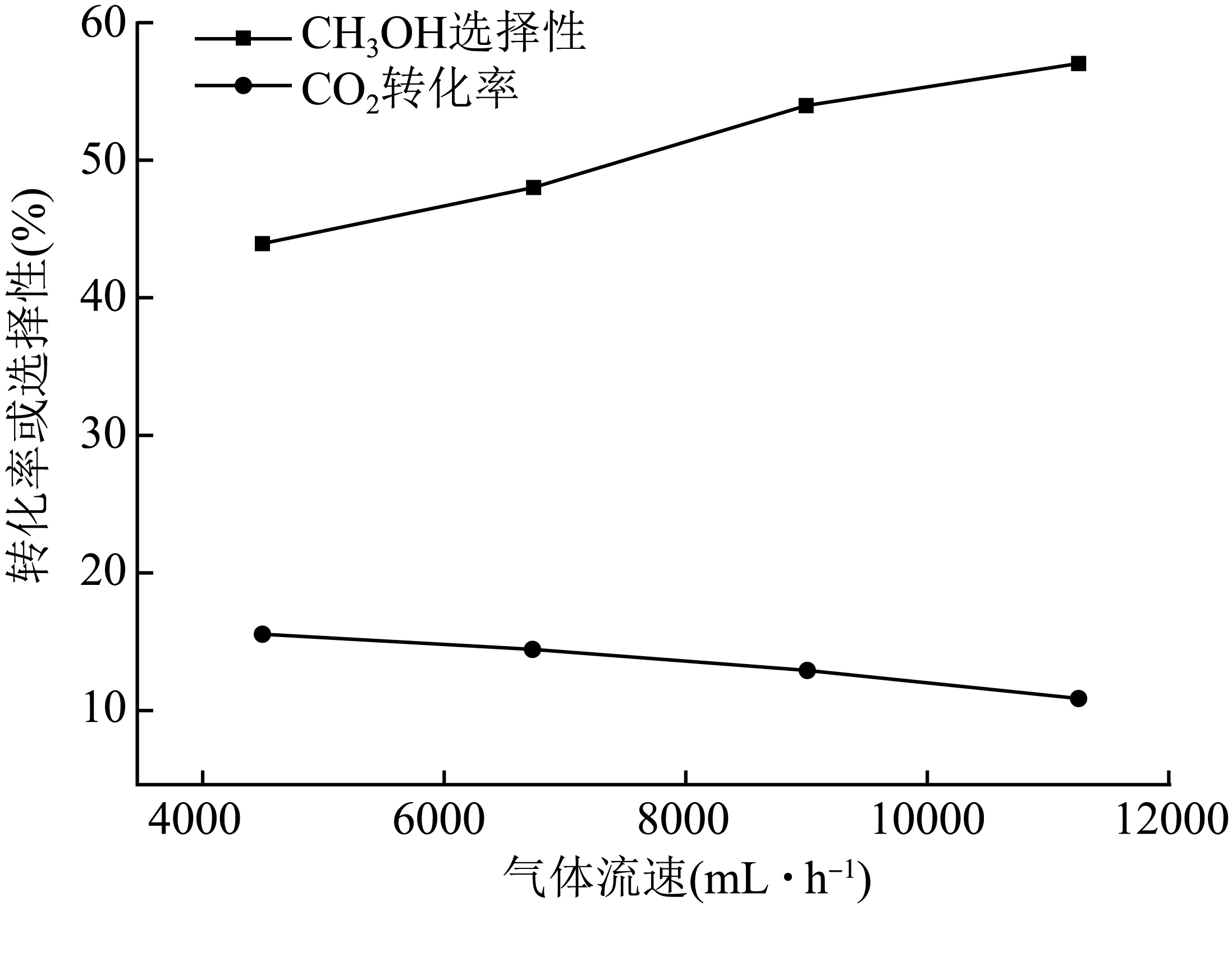
① 。
②气体流速增大可减少产物中${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$的积累,减少催化剂的失活,从而提高$\text{C}{{\text{H}}_{3}}\text{OH}$选择性,请用化学方程式表示催化剂失活的原因: 。
增大$\\text{C}{{\\text{O}}_{2}}$与${{\\text{H}}_{2}}$混合气体流速可增大压强。①正向移动,生成$\\text{C}{{\\text{H}}_{3}}\\text{OH}$消耗$\\text{C}{{\\text{O}}_{2}}$物质的量增大,导致$\\text{C}{{\\text{H}}_{3}}\\text{OH}$选择性升高;$\\text{I}{{\\text{n}}_{\\text{2}}}{{\\text{O}}_{ {3-x}}}{+x}{{\\text{H}}_{\\text{2}}}\\text{O=I}{{\\text{n}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}} {+x}{{\\text{H}}_{\\text{2}}}$
"]]①增大$\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$混合气体流速可增大压强。①正向移动,生成$\text{C}{{\text{H}}_{3}}\text{OH}$消耗$\text{C}{{\text{O}}_{2}}$物质的量增大,导致$\text{C}{{\text{H}}_{3}}\text{OH}$选择性升高。
②根据题意,水能氧化$\text{I}{{\text{n}}_{\text{2}}}{{\text{O}}_{ {3-x}}}$而使催化剂失活, 发生反应$\text{I}{{\text{n}}_{\text{2}}}{{\text{O}}_{ {3-x}}} {+x}{{\text{H}}_{\text{2}}}\text{O=I}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{3}}} {+x}{{\text{H}}_{\text{2}}}$,所以气体流速增大可减少产物中${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$的积累,减少催化剂的失活,从而提高$\text{C}{{\text{H}}_{3}}\text{OH}$选择性。
碳酸氢盐分解可获得$\text{C}{{\text{O}}_{2}}$,在$ T\;^\circ\rm C$时,将足量的某碳酸氢盐$\left( \text{MHC}{{\text{O}}_{3}} \right)$固体置于真空恒容容器中,存在如下平衡:$2\text{MHC}{{\text{O}}_{3}}\left( \text{s} \right)\rightleftharpoons {{\text{M}}_{2}}\text{C}{{\text{O}}_{3}}\left( \text{s} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$。上述反应达平衡时体系的总压为${{ {p}}_{\text{0}}}\text{ kPa}$。保持温度不变,开始时在体系中先通入一定量的$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$,再加入足量$\text{MHC}{{\text{O}}_{3}}\left( \text{s} \right)$,欲使平衡时体系中水蒸气的分压小于${{ {p}}_{\text{1}}}\text{ kPa}$,则开始时通入$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的初始压强应大于 。
$\\dfrac{p_0^2}{4 p_1}-p_1$
"]]$2\text{MHC}{{\text{O}}_{3}}\left( \text{s} \right)\rightleftharpoons {{\text{M}}_{2}}\text{C}{{\text{O}}_{3}}\left( \text{s} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$反应达平衡时体系的总压为${{ {p}}_{\text{0}}}\text{ kPa}$。则平衡常数为$\dfrac{{{ {P}}_{\text{0}}}^{2}}{4}$;保持温度不变,开始时在体系中先通入一定量的$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$,设$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的初始压强为$P$,再加入足量$\text{MHC}{{\text{O}}_{3}}\left( \text{s} \right)$,欲使平衡时体系中水蒸气的分压等于${{ {p}}_{\text{1}}}\text{ kPa}$,则${{ {P}}_{\text{1}}}\times \left( {P+}{{ {P}}_{\text{1}}} \right)=\dfrac{{{ {P}}_{\text{0}}}^{\text{2}}}{\text{4}}$,$ P=\dfrac{p_0^2}{4 p_1}-p_1$;欲使平衡时体系中水蒸气的分压小于${{ {p}}_{\text{1}}}\text{ kPa}$,则开始时通入$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的初始压强应大于$\dfrac{p_0^2}{4 p_1}-p_1$。
$\rm II$.一种以甲醇和二氧化碳为原料,利用活性催化电极,电化学法制备甲酸$\rm ($甲酸盐$\rm )$,其工作原理如图所示。

①$\rm b$极为直流电源的 极,写出电解过程中阴极表面发生的电极反应式: 。
②若有$\rm 1\;\rm mol{{\text{ H}}^{+}}$通过质子交换膜时,该装置内生成$\rm \text{HCO}{{\text{O}}^{-}}$和$\rm HCOOH$共计 $\rm \;\rm mol$。
正;$\\rm \\text{C}{{\\text{O}}_{\\text{2}}}\\text{+2}{{\\text{e}}^{-}}\\text{+HCO}_{\\text{3}}^{-}\\text{=HCO}{{\\text{O}}^{-}}\\text{+CO}_{\\text{3}}^{\\text{2-}}$;$\\rm 0.75$
"]]右侧电极甲醇中碳元素化合价升高发生氧化反应生成甲酸,右侧为阳极,所以$\rm b$极为直流电源的正极,电解过程中阴极表面二氧化碳得电子生成$\rm HCOO^{-}$,发生的电极反应式$\rm \text{C}{{\text{O}}_{\text{2}}}\text{+2}{{\text{e}}^{-}}\text{+HCO}_{\text{3}}^{-}\text{=HCO}{{\text{O}}^{-}}\text{+CO}_{\text{3}}^{\text{2-}}$。
②若有$\rm 1\;\rm mol{{\text{ H}}^{+}}$通过质子交换膜时,转移$\rm 1\;\rm mol$电子,根据$\rm \text{C}{{\text{O}}_{\text{2}}}\text{+2}{{\text{e}}^{-}}\text{+HCO}_{\text{3}}^{-}\text{=HCO}{{\text{O}}^{-}}\text{+CO}_{\text{3}}^{\text{2-}}$,左侧生成$\rm 0.5\;\rm mol\text{ HCO}{{\text{O}}^{-}}$,根据阳极反应式$\rm \text{C}{{\text{H}}_{\text{3}}}\text{OH}-4{{\text{e}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}=\text{HCOOH}+4{{\text{H}}^{+}}$,右侧生成$\rm 0.25\;\rm mol\;\rm HCOOH$,所以该装置内生成$\rm \text{HCO}{{\text{O}}^{-}}$和$\rm HCOOH$共计$\rm 0.75\;\rm mol$。
高中 | 杂化轨道理论题目答案及解析(完整版)
