高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
中国科学院上海微系统与信息技术研究所发明了一种新型基于单质碲和氮化钛电极界面效应的开关器件,该研究突破为我国发展海量存储和近存计算在大数据时代参与国际竞争提供了新的技术方案,该成果荣获$\rm 2022$年度中国科学十大进展。回答下列问题:
工业上以铜阳极泥$\rm ($主要成分$\text{C}{{\text{u}}_{2}}\text{Te}\rm )$为原料提取碲$\rm (Te)$,涉及如下反应:
Ⅰ.$\text{C}{{\text{u}}_{2}}\text{Te}+2{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}=2\text{CuS}{{\text{O}}_{4}}+\text{Te}{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}$,
Ⅱ.$\text{Te}{{\text{O}}_{2}}+2\text{S}{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=2{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}+\text{Te}$
下列说法正确的是$(\quad\ \ \ \ )$
$\\text{C}{{\\text{u}}_{2}}\\text{Te}$中$\\text{Cu}$元素的化合价是$\\rm +2$价
","氧化性强弱顺序为:${{\\text{O}}_{2}}\\gt \\text{S}{{\\text{O}}_{2}}\\gt \\text{Te}{{\\text{O}}_{2}}$
","$\\rm II$中氧化剂是$\\text{S}{{\\text{O}}_{2}}$,氧化产物是${{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$
","生成$1\\text{ mol Te}{{\\text{O}}_{2}}$理论上转移$8\\;\\rm \\text{mol}$电子
"]$\rm A\rm .$根据正负化合价的代数和为零可知,$\rm Cu_{2}Te$中$\rm Cu$元素的化合价为$\rm +1$价,故$\rm A$错误;
$\rm B\rm .$由反应Ⅱ可知,$\rm TeO_{2}$为氧化剂,$\rm SO_{2}$为还原剂,氧化性:$\rm TeO_{2}\gt SO_{2}$,故$\rm B$错误;
$\rm C\rm .$Ⅱ中$\rm S$元素化合价升高,$\rm SO_{2}$为还原剂,$\rm H_{2}SO_{4}$为氧化产物,故$\rm C$错误;
$\rm D\rm .$反应Ⅰ中,$\rm Te$元素化合价由$\rm -2$变为$\rm +4$,$\rm Cu$元素化合价由$\rm +1$变为$\rm +2$,生成$\rm 1\;\rm mol\;\rm TeO_{2}$理论上转移$\rm 8\;\rm mol$电子,故$\rm D$正确;
氧、硫、硒、碲在周期表中位于同一主族。
①补全基态碲原子的简化电子排布式:$[\mathrm{Kr}]$ ,
②碲的最高价氧化物的水化物碲酸$\left( {{\text{H}}_{6}}\text{Te}{{\text{O}}_{6}} \right)$的酸性比${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$ $\rm ($选填“强”或“弱”$\rm )$,其氧化性比硫酸强。向碲酸中通入$\text{S}{{\text{O}}_{2}}$气体,若反应中生成的$\text{Te}{{\text{O}}_{2}}$与$\text{Te}$的物质的量之比为$\rm 2:1$,写出反应的化学方程式 。
$4{{\\text{d}}^{10}}5{{\\text{s}}^{2}}5{{\\text{p}}^{4}}$;弱;$5 \\mathrm{SO}_2+3 \\mathrm{H}_6 \\mathrm{TeO}_6=2 \\mathrm{TeO}_2 \\downarrow+\\mathrm{Te} \\downarrow+5 \\mathrm{H}_2 \\mathrm{SO}_4+4 \\mathrm{H}_2 \\mathrm{O}$
"]]①碲原子位于周期表中第五周期第Ⅵ$\rm A$族,基态碲原子的简化电子排布式:$\rm [Kr]4d^{10}5s^{2}5p^{4}$;
②非金属性越强,其最高价氧化物对应的水化物的酸性越强,非金属性:$\rm S\gt Te$,酸性:$\rm H_{6}TeO_{6}\gt H_{2}SO_{4}$;向碲酸中通入$\rm SO_{2}$气体,$\rm H_{6}TeO_{6}$将$\rm SO_{2}$氧化为$\rm H_{2}SO_{4}$,本身被还原为$\rm TeO_{2}$与$\rm Te$,化学反应方程式为:$\rm 5SO_{2}+3H_{6}TeO_{6}=2TeO_{2}↓+Te↓+5H_{2}SO_{4}+4H_{2}O$;
钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
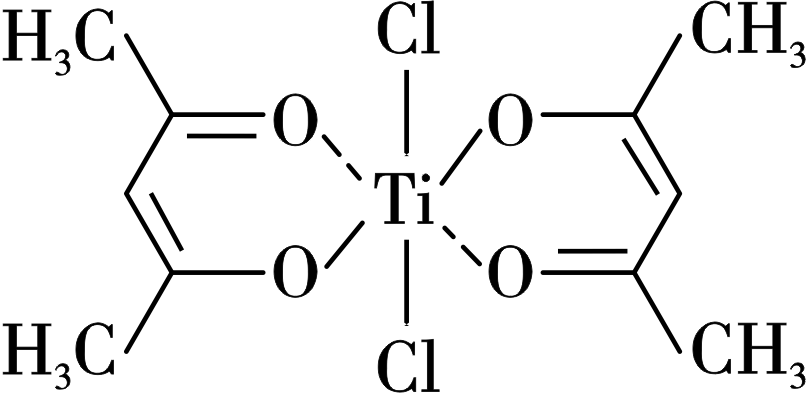
①碳原子的杂化类型有 种。
②该配合物中存在的化学键有 $\rm ($填字母$\rm )$。
$\rm a$.离子键 $\rm b$.配位键 $\rm c$.金属键
$\rm d$.共价键 $\rm e$.氢键
$\\rm 2$;$\\rm bd$
"]]①由钛的某配合物结构图可知,甲基中$\rm C$原子形成$\rm 4$个$\rm \sigma$键,价层电子对数为$\rm 4$,为$\rm sp^{3}$杂化;其他$\rm C$原子形成$\rm 3$个$\rm \sigma$键,价层电子对数为$\rm 3$,为$\rm sp^{2}$杂化,$\rm C$原子共有$\rm 2$种杂化方式;
②由钛的某配合物结构图可知,$\rm Ti$提供空轨道,$\rm O$提供孤电子对,形成配位键,存在$\rm C-H$键、$\rm C=C$、$\rm C-C$键、$\rm C-O$键等共价键;
氮化钛晶体的晶胞结构如图所示,该晶体结构中与$\rm N$原子距离最近且相等的$\text{Ti}$原子有 个;若该晶胞的密度为$ \rho \text{ g}/\text{c}{{\text{m}}^{3}}$,阿伏加德罗常数的值为${{ {N}}_{\text{A}}}$,则晶胞中$\text{Ti}$原子与$\text{N}$原子的最近距离为 $\rm pm$。$\rm ($用含$\rho$、$ {{ {N}}_{\text{A}}}$的代数式表示$\rm )$
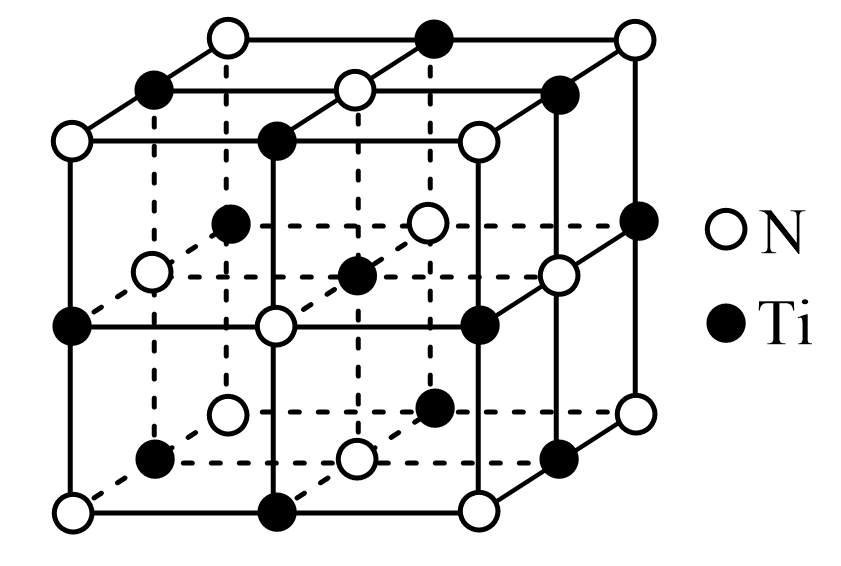
$\\rm 6$;$\\sqrt[{3}]{\\dfrac{{31}}{\\rho{ }{{{N}}_{\\rm {A}}}}}\\times {{10}^{10}}$
"]]由氮化钛晶体的晶胞结构图可知,与$\rm N$原子距离最近且相等的$\rm Ti$原子位于$\rm N$原子的上下左右前后,该晶体结构中与$\rm N$原子距离最近且相等的$\rm Ti$原子有$\rm 6$个;设晶胞边长为$a\;\rm pm$,则晶胞体积为$(a\times 10^{-10})^{3}\rm \;pm^{3}$,晶胞中$\rm Ti$原子位于棱心和体心,个数为$\rm 12\times \dfrac{1}{4}\rm +1=4$,$\rm N$原子位于顶点和面心,个数为$\rm 8\times \dfrac{1}{8}\rm +6\times \dfrac{1}{2}\rm =4$,则晶胞质量为$\dfrac{\begin{array}{*{35}{l}} 4\times \left( 48+14 \right) \\ \end{array}}{{{{N}}_{\rm {A}}}}\;\rm g$,根据$\rho{ =}\dfrac{{m}}{{V}}=\dfrac{\dfrac{\begin{array}{*{35}{l}} 4\times \left( 48+14 \right) \\ \end{array}}{{{{N}}_{\rm {A}}}}}{\begin{array}{*{35}{l}} {{\left( a\times {{10}^{-10}} \right)}^{3}} \\ \end{array}}$,可得$ a=\sqrt[{3}]{\dfrac{{248}}{\rho{{{N}}_{\rm {A}}}}}\times {{10}^{10}}\;\rm pm$,与$\rm N$原子的最近距离为边长的一半,即$\sqrt[{3}]{\dfrac{{31}}{\rho{{{N}}_{\rm {A}}}}}\times {{10}^{10}}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
