高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
下列说法正确的是$(\quad\ \ \ \ )$
$\\text{ClO}_{\\text{3}}^{-}$和$\\text{ClO}_{\\text{4}}^{-}$中键角相等
","$\\text{S}{{\\text{O}}_{\\text{2}}}{{\\text{F}}_{\\text{2}}}$的中心原子$\\rm S$采用$\\text{s}{{\\text{p}}^{\\text{2}}}$杂化
","$\\text{Br}$原子基态核外电子排布式为$[\\!\\!\\text{ Ar }\\!\\!]\\!\\!\\text{ 4}{{\\text{s}}^{\\text{2}}}\\text{4}{{\\text{p}}^{\\text{5}}}$
","$\\text{NaCl}$晶胞中,每个$\\text{N}{{\\text{a}}^{+}}$周围紧邻且距离相等的$\\text{C}{{\\text{l}}^{-}}$构成正八面体结构
"]$\rm A$.$\text{ClO}_{\text{3}}^{-}$中心原子氯的价层电子对数是$3+\dfrac{7+13\times 2}{2}=4$,中心原子$\rm Cl$为$\rm sp^{3}$杂化,含有$\rm 1$对孤对电子,空间构型为三角锥形,键角小于$\rm 109^\circ28^\prime$,$\text{ClO}_{\text{4}}^{-}$中心原子氯的价层电子对数是$4+\dfrac{7+14\times 2}{2}=4$,中心原子$\rm Cl$为$\rm sp^{3}$杂化,无孤对电子,空间构型为正四面体形,键角等于$\rm 109^\circ28^\prime$,即键角$\text{ClO}_{\text{4}}^{-}\rm \gt \text{ClO}_{\text{3}}^{-}$,$\rm A$错误;
$\rm B$.$\text{S}{{\text{O}}_{\text{2}}}{{\text{F}}_{\text{2}}}$的中心原子$\rm S$的价层电子对数为$4+\dfrac{62\times 22\times 1}{2}=4$,则中心原子$\rm S$采用$\text{s}{{\text{p}}^{3}}$杂化,$\rm B$错误;
$\rm C$.$\text{Br}$原子与$\rm Cl$原子位于同一主族$\rm ($Ⅶ$\rm A$族$\rm )$,$\rm Br$比$\rm Cl$多了一个电子层,基态$\rm Br$原子核外电子排布式为$[\!\!\text{ Ar }\!\!]\!\!\text{ 3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{2}}}\text{4}{{\text{p}}^{\text{5}}}$,$\rm C$错误;
$\rm D$.由$\rm NaCl$晶胞结构可知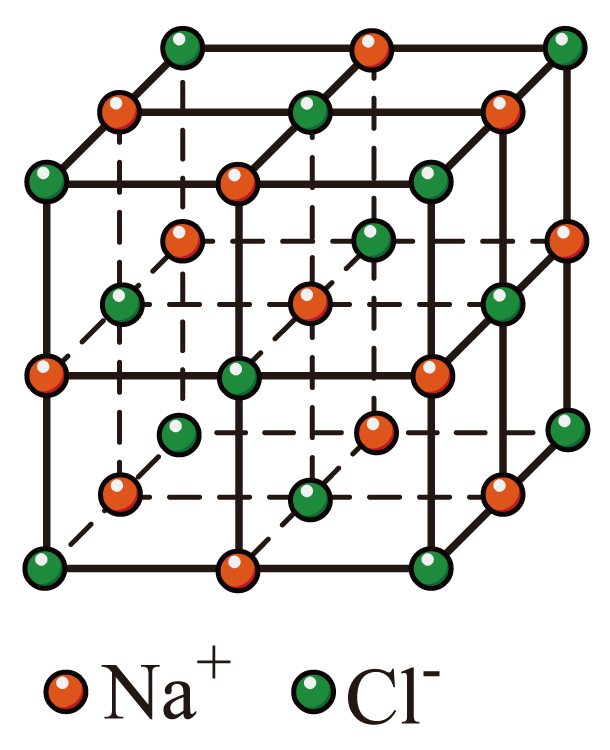 ,体心的$\text{N}{{\text{a}}^{+}}$周围紧邻且距离相等的$\rm 6$个$\text{C}{{\text{l}}^{-}}$位于$\rm 6$个面的面心,即围成正八面体结构,$\rm D$正确;
,体心的$\text{N}{{\text{a}}^{+}}$周围紧邻且距离相等的$\rm 6$个$\text{C}{{\text{l}}^{-}}$位于$\rm 6$个面的面心,即围成正八面体结构,$\rm D$正确;
故选:$\rm D$
高中 | 杂化轨道理论题目答案及解析(完整版)
