高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
给出以下几种物质:①$\text{C}{{\text{O}}_{2}}$;②$\text{HCl}$;③$\text{C}{{\text{H}}_{3}}\text{COOH}$;④$\rm NaCl$晶体;⑤酒精;⑥熔融$\rm KOH$;⑦水银;⑧$\text{Fe(OH}{{\text{)}}_{\text{3}}}$胶体;⑨$\text{KHS}{{\text{O}}_{4}}$固体;⑩$\rm Ba{{(\text{OH})}_{2}}$溶液;⑪$\text{N}{{\text{H}}_{3}}$;⑫$\rm NaOH$固体;
上述物质是电解质的有 $\rm ($填序号$\rm )$,上述物质中能导电的纯净物为 $\rm ($填序号$\rm )$。
②③④⑥⑨⑫ ; ⑥⑦
"]]①$\text{C}{{\text{O}}_{\text{2}}}$溶于水产生碳酸,碳酸可以电离出自由移动的离子,因此可以导电,但并非是$\rm CO_{2}$自身电离出的离子导电,因此$\text{C}{{\text{O}}_{\text{2}}}$为非电解质;
②$\rm HCl$溶于水后可以产生自由移动的离子,可以导电,因此$\rm HCl$为电解质;
③$\text{C}{{\text{H}}_{\text{3}}}\text{OOH}$溶于水后可以产生自由移动的离子,可以导电,因此$\text{C}{{\text{H}}_{\text{3}}}\text{OOH}$为电解质;
④$\text{NaCl}$晶体溶于水或熔融状态下均可以产生自由移动的离子,可以导电,因此$\text{NaCl}$为电解质;
⑤酒精在水中和熔融状态下无法电离出自由移动的离子,为非电解质;
⑥熔融$\rm KOH$含有自由移动的离子,可以导电,因此熔融$\rm KOH$为电解质;
⑦水银为单质$\rm H$ $\rm g$,既不是电解质也不是非电解质,但是可以导电;
⑧$\rm Fe(OH)_{3}$胶体是混合物,既不是电解质也不是非电解质;
⑨$\rm KHSO_{4}$固体溶于水或熔融状态下均可以产生自由移动的离子,可以导电,因此$\rm KHSO_{4}$固体为电解质;
⑩$\text{Ba}{{\left( \text{OH} \right)}_{\text{2}}}$溶液是混合物,既不是电解质也不是非电解质;
⑪$\rm NH_{3}$溶于水产生一水合氨,一水合氨可以电离出自由移动的离子,因此可以导电,但并非是$\rm NH_{3}$自身电离出的离子导电,因此$\rm NH_{3}$为非电解质;
⑫$\text{NaOH}$固体溶于水或熔融状态下均可以产生自由移动的离子,可以导电,因此$\text{NaOH}$固体为电解质;
是电解质的有②③④⑥⑨⑫;上述物质中能导电的纯净物为⑥⑦;
写出⑨在水中的电离方程式为 。
$\\mathrm{KHSO}_{4}=\\mathrm{K}^{+}+\\mathrm{H}^{+}+\\mathrm{SO}_{4}^{2-}$
"]]$\text{KHS}{{\text{O}}_{\text{4}}}$为强电解质,在水溶液中完全电离,也是强酸的酸式盐,电离方程式为:$\mathrm{KHSO}_{4}=\mathrm{K}^{+}+\mathrm{H}^{+}+\mathrm{SO}_{4}^{2-}$;
用化学方程式表示⑧的实验室制备方法: 。
$\\text{FeC}{{\\text{l}}_{3}}+3{{\\text{H}}_{2}}\\text{O}\\begin{matrix} \\underline{\\underline{_{\\triangle }}} \\\\ {} \\\\ \\end{matrix}\\ \\text{Fe}{{(\\text{OH})}_{3}}\\rm ($胶体$\\rm )+3 \\mathrm{HCl} \\quad$
"]]向沸水中加入几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色即可得到氢氧化铁胶体,化学方程式为$\text{FeC}{{\text{l}}_{3}}+3{{\text{H}}_{2}}\text{O}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}\ \text{Fe}{{(\text{OH})}_{3}}\rm ($胶体$\rm )+3\text{HCl}$;
将⑨逐滴加入⑩的溶液中,至恰好沉淀完全,写出相应的离子方程式为 ,在反应后混合液中滴加紫色石蕊,现象是混合液 $\rm ($填“变红”、“变蓝”、“不变色”$\rm )$。
$\\text{B}{{\\text{a}}^{2+}}+{{\\text{H}}^{+}}+\\text{SO}_{4}^{2-}+\\text{O}{{\\text{H}}^{-}}=\\text{BaS}{{\\text{O}}_{4}}\\downarrow +{{\\text{H}}_{2}}\\text{O}$ ; 变蓝
"]]将$\text{KHS}{{\text{O}}_{\text{4}}}$溶液逐滴滴入到$\text{Ba}{{\left( \text{OH} \right)}_{\text{2}}}$溶液中,至恰好沉淀完全,发生的反应为$\text{Ba(OH}{{\text{)}}_{\text{2}}}+\text{KHS}{{\text{O}}_{\text{4}}}=\text{BaS}{{\text{O}}_{\text{4}}}\downarrow +\text{KOH}+{{\text{H}}_{\text{2}}}\text{O}$,离子方程式为$\text{B}{{\text{a}}^{2+}}+{{\text{H}}^{+}}+\text{SO}_{4}^{2-}+\text{O}{{\text{H}}^{-}}=\text{BaS}{{\text{O}}_{\text{4}}}\downarrow +{{\text{H}}_{\text{2}}}\text{O}$;由化学方程式可知,反应后溶液为碱性,在反应后混合液中滴加紫色石蕊,现象是混合液变蓝;
向⑫的水溶液中通入②气体至恰好反应完全,此过程中溶液的导电能力 $\rm ($填“显著增强”、“显著减弱”、“几乎不变”、“先增大后减小”、“先减小后增大”$\rm )$。
几乎不变
"]]向氢氧化钠溶液中通入$\rm HCl$气体,生成氯化钠和水,溶液中阴阳离子浓度几乎不变,导电能力几乎不变;
将过量的①通入⑫的水溶液中反应的离子方程式为 。
$\\text{C}{{\\text{O}}_{2}}+\\text{O}{{\\text{H}}^{-}}=\\text{HCO}_{3}^{-}$
"]]将过量的二氧化碳通入到$\rm NaOH$水溶液中,产生$\rm NaHCO_{3}$,反应的离子方程式为$\text{O}{{\text{H}}^{-}}+\text{C}{{\text{O}}_{\text{2}}}=\text{HCO}_{3}^{-}$。
侯氏制碱法又称联合制碱法,是由我国化学家侯德榜发明。侯氏制碱法的过程如图所示:
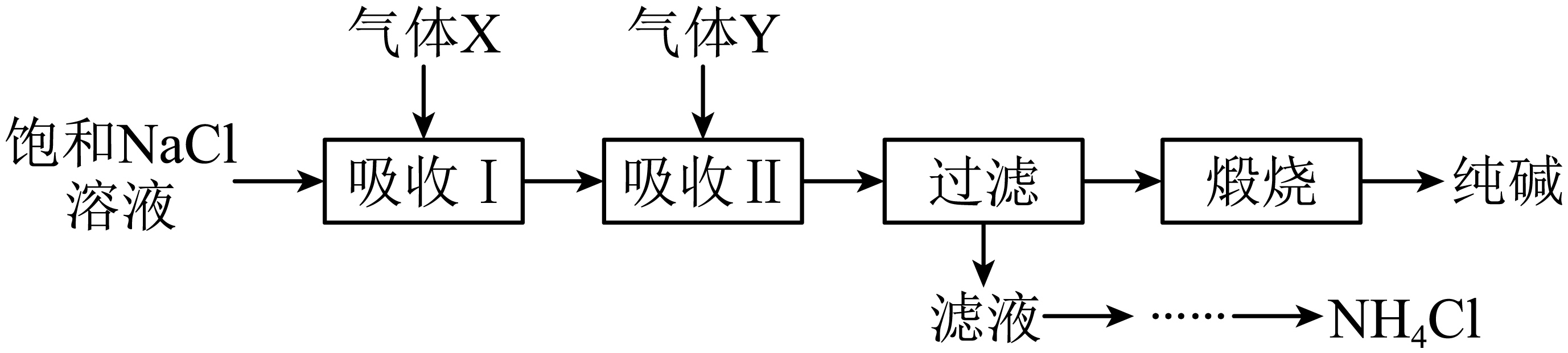
上述制备流程中气体$\rm X$为 ,气体$\rm Y$为 $\rm ($填序号$\rm )$;将两种气体通入④的饱和溶液中发生反应的化学方程式为 。在上述煅烧过程中得到的产物在$300\text{ }{}^\circ \text{C}$加热得到纯碱,可选择下列仪器中的 $\rm ($填仪器名称$\rm )$。
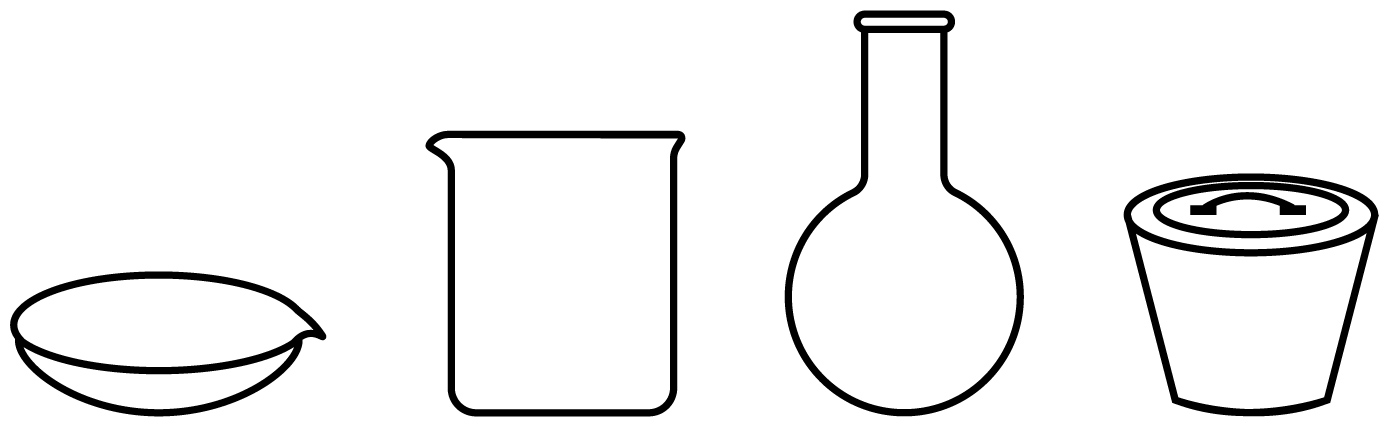
⑪ ; ① ; $\\text{NaCl}+\\text{N}{{\\text{H}}_{3}}+\\text{C}{{\\text{O}}_{2}}+{{\\text{H}}_{2}}\\text{O}=\\text{N}{{\\text{H}}_{4}}\\text{Cl}+\\text{NaHC}{{\\text{O}}_{3}}\\downarrow $ ; 坩埚
"]]饱和$\rm NaCl$溶液中先通入$\rm NH_{3}$,此时溶液呈碱性,随后通入$\rm CO_{2}$,此时$\rm NaCl$、$\rm NH_{3}$、$\rm CO_{2}$反应生成$\rm NaHCO_{3}$和$\rm NH_{4}Cl$,该条件下碳酸氢钠在水中的溶解度较小,结晶析出,过滤得到碳酸氢钠固体,煅烧碳酸氢钠得到碳酸钠,滤液中含有氯化铵,氯化铵经过蒸发浓缩、冷却结晶等操作得到$\rm NH_{4}Cl$固体。
由上述分析可知,$\rm X$为$\rm NH_{3}$、$\rm Y$为$\rm CO_{2}$;吸收Ⅱ时,$\rm NaCl$溶液、$\rm NH_{3}$、$\rm CO_{2}$反应生成$\rm NaHCO_{3}$和$\rm NH_{4}Cl$,$\rm NaHCO_{3}$此条件下在水中溶解度较小,结晶析出,化学方程式为$\text{NaCl}+\text{N}{{\text{H}}_{3}}+\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\text{O}=\text{N}{{\text{H}}_{4}}\text{Cl}+\text{NaHC}{{\text{O}}_{3}}\downarrow $;煅烧碳酸氢钠固体制取纯碱应该用坩埚。
高中 | 导电的原因及条件题目答案及解析(完整版)
