高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
在保温杯式量热计中$\rm ($如图$\rm )$,将$100\;\rm \text{mL}$、$0.500\;\rm \text{mol}/\text{L\ C}{{\text{H}}_{3}}\text{COOH}$溶液与$100\;\rm \text{mL}$、$0.55\;\rm \text{mol}/\text{L\ NaOH}$溶液混合,温度从$298.2\text{\ K}$升高到$301.2\text{\ K}$。$\rm ($已知:低浓度$\text{C}{{\text{H}}_{3}}\text{COONa}$溶液比热容${c=4}\text{.2}{\text{\ J}}/{\left( \text{g}\cdot \text{K} \right)}\;$,溶液的密度为$1\ {\text{g}}/{\text{c}{{\text{m}}^{3}}}\;\rm )$
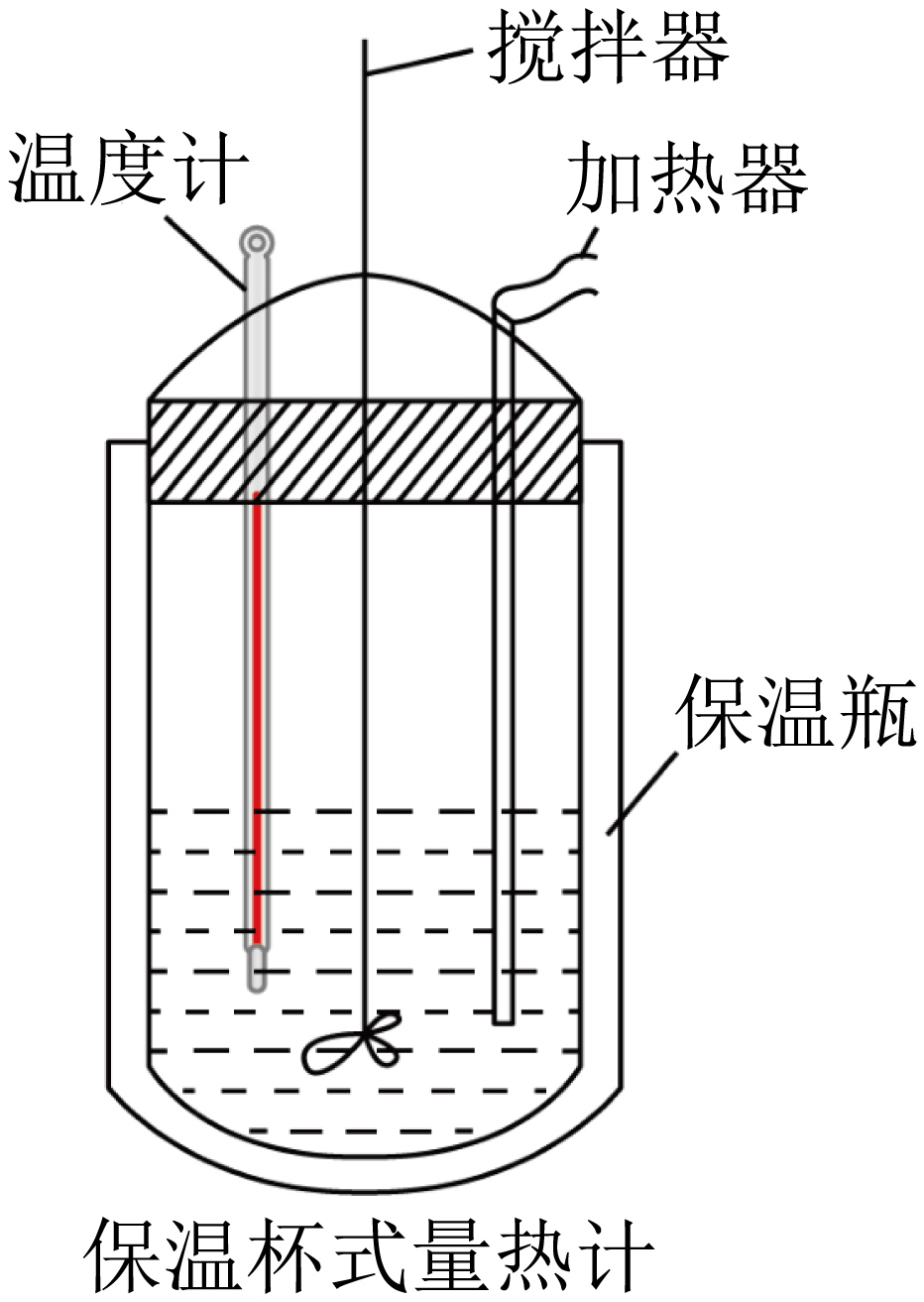
有关中和热测定,下列说法正确的是$(\quad\ \ \ \ )$。
测定中和热的实验中,至少需要测定并记录温度的次数是$\\rm 3$次
","表示中和热的离子方程式为:${{\\text{H}}^{+}}\\left( \\text{aq} \\right)+\\text{O}{{\\text{H}}^{-}}\\left( \\text{aq} \\right)={{\\text{H}}_{2}}\\text{O}\\left( \\text{l} \\right)\\quad \\Delta{ H=57}\\text{.3}{\\text{\\ kJ}}/{\\text{mol}}\\;$
","若改用$100\\;\\rm \\text{mL}\\;\\rm 0.50\\;\\rm \\text{mol}/\\text{L}$盐酸跟$100\\;\\rm \\text{mL}\\;\\rm 0.55\\;\\rm \\text{mol}/\\text{L}$的$\\text{NaOH}$溶液进行反应,所放出热量相等
","用保温杯式量热计来代替烧杯做测定中和热的实验,能有效防止热量损失
"]$\rm A$.测定中和热的实验中,为保证实验数据的准确性,至少需要测定并记录温度$\rm 3$次,$\rm A$项正确;
$\rm B$.酸碱中和是放热反应,表示中和热的离子方程式为:${{\text{H}}^{+}}\left( \text{aq} \right)+\text{O}{{\text{H}}^{-}}\left( \text{aq} \right)={{\text{H}}_{2}}\text{O}\left( \text{l} \right)$ $\quad \Delta{ H=-57}\text{.3}{\text{kJ}}/{\text{mol}}\;$,$\rm B$项错误;
$\rm C$.醋酸是弱酸,在水溶液中电离吸收热量,若改用$100\;\rm \text{mL}\;\rm 0.50\;\rm \text{mol}/\text{L}$盐酸跟$100\;\rm \text{mL}\;\rm 0.55\;\rm \text{mol}/\text{L}$的$\text{NaOH}$溶液进行反应,二者所放出热量不同,$\rm C$项错误;
$\rm D$.用保温杯式量热计来代替烧杯做测定中和热的实验,能有效防止热量损失,减少实验误差,$\rm D$项正确;
实验中$\text{NaOH}$溶液过量的目的是 。
确保醋酸完全被$\\text{NaOH}$中和
"]]实验中$\text{NaOH}$溶液过量是为了确保醋酸完全被$\text{NaOH}$中和;
通过计算,写出$\text{C}{{\text{H}}_{3}}\text{COOH}$中和反应热方程式 。
$\\text{C}{{\\text{H}}_{3}}\\text{COOH}\\left( \\text{aq} \\right)+\\text{NaOH}\\left( \\text{aq} \\right)=\\text{C}{{\\text{H}}_{3}}\\text{COONa}\\left( \\text{aq} \\right)+{{\\text{H}}_{2}}\\text{O}\\left( \\text{l} \\right)\\text{ }\\quad \\Delta{ H=-50}\\text{.4}{\\text{kJ}}/{\\text{mol}}\\;$
"]]有分析可知,醋酸和氢氧化钠反应生成$\rm 0.05\;\rm mol$ $\rm H_{2}O$放出的热量为$\rm 2.52\;\rm kJ$,则生成$\rm 1\;\rm mol$ $\rm H_{2}O$放出的热量为$\dfrac{{1}}{{0}{.05}}\times {2}{.52\;\rm kJ}\rm =50.4\;\rm kJ$,故$\text{C}{{\text{H}}_{3}}\text{COOH}$中和反应热方程式为$\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{aq} \right)+\text{NaOH}\left( \text{aq} \right)=\text{C}{{\text{H}}_{3}}\text{COONa}\left( \text{aq} \right)+{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\text{ }\quad \Delta{ H=-50}\text{.4}{\text{kJ}}/{\text{mol}}\;$;
化学反应速率、化学平衡理论通过大量化学实验进行验证,在重铬酸钾溶液中存在$\text{C}{{\text{r}}_{2}}\text{O}_{7}^{2-}\rm ($橙色$\rm )$与$\text{CrO}_{4}^{2-}\rm ($黄色$\rm )$之间的平衡体系,若向体系中加入足量$\rm 70\%$的硫酸,溶液呈橙色,则该平衡体系的离子方程式为 。
$\\text{C}{{\\text{r}}_{2}}\\text{O}_{7}^{2-}+{{\\text{H}}_{2}}\\text{O}\\rightleftharpoons \\text{2CrO}_{4}^{2-}+2{{\\text{H}}^{+}}$
"]]向体系中加入足量$\rm 70\%$的硫酸,溶液呈橙色,说明加入硫酸,促进$\text{CrO}_{4}^{2-}$转化为$\text{C}{{\text{r}}_{2}}\text{O}_{7}^{2-}$,则反应的离子方程式为$\text{C}{{\text{r}}_{2}}\text{O}_{7}^{2-}+{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{2CrO}_{4}^{2-}+2{{\text{H}}^{+}}$;
向$3\;\rm \text{mL}\;\rm 0.1\;\rm \text{mol}/\text{L}$稀盐酸中加入$1\;\rm \text{mL}\;\rm 0.1\;\rm \text{mol}/\text{L}$氯化钴溶液发生反应:${{\left[ \text{Co}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{6}} \right]}^{2+}}\mathrm{粉红色}+4\text{C}{{\text{l}}^{-}}\rightleftharpoons {{\left( \text{CoC}{{\text{l}}_{4}} \right)}^{2-}}\mathrm{蓝色}+6{{\text{H}}_{2}}\text{O}\quad \Delta H\gt 0$,平衡时溶液呈浅紫色。下列说法错误的是$(\quad\ \ \ \ )$。
加热溶液会逐渐变成蓝色
","向溶液中加$\\text{AgN}{{\\text{O}}_{3}}$,如果生成白色沉淀说明该反应存在限度
","加入少量水,平衡会逆向移动
","加入$\\text{NaCl}$固体,平衡右移,但平衡常数不变
"]$\rm A$.该反应为吸热反应,加热平衡正向移动,溶液变蓝,$\rm A$项正确;
$\rm B$.向$3\;\rm \text{mL}\;\rm 0.1\;\rm \text{mol}/\text{L}$稀盐酸中加入$1\;\rm \text{mL}\;\rm 0.1\;\rm \text{mol}/\text{L}$氯化钴溶液,盐酸过量,加入$\text{AgN}{{\text{O}}_{3}}$生成白色沉淀,不能说明该反应存在限度,$\rm B$项错误;
$\rm C$.加入少量水,生成物浓度增大,平衡逆向移动,$\rm C$项正确;
$\rm D$.加入$\text{NaCl}$固体,$\rm Cl^{-}$浓度增大,平衡正向移动,温度不变,平衡常数不变,$\rm D$项正确;
高中 | 离子方程式题目答案及解析(完整版)
