高中 | 萃取与分液 题目答案及解析
稿件来源:高途
高中 | 萃取与分液题目答案及解析如下,仅供参考!
必修一
第一章 从实验学化学
第一节 化学实验基本方法
萃取与分液
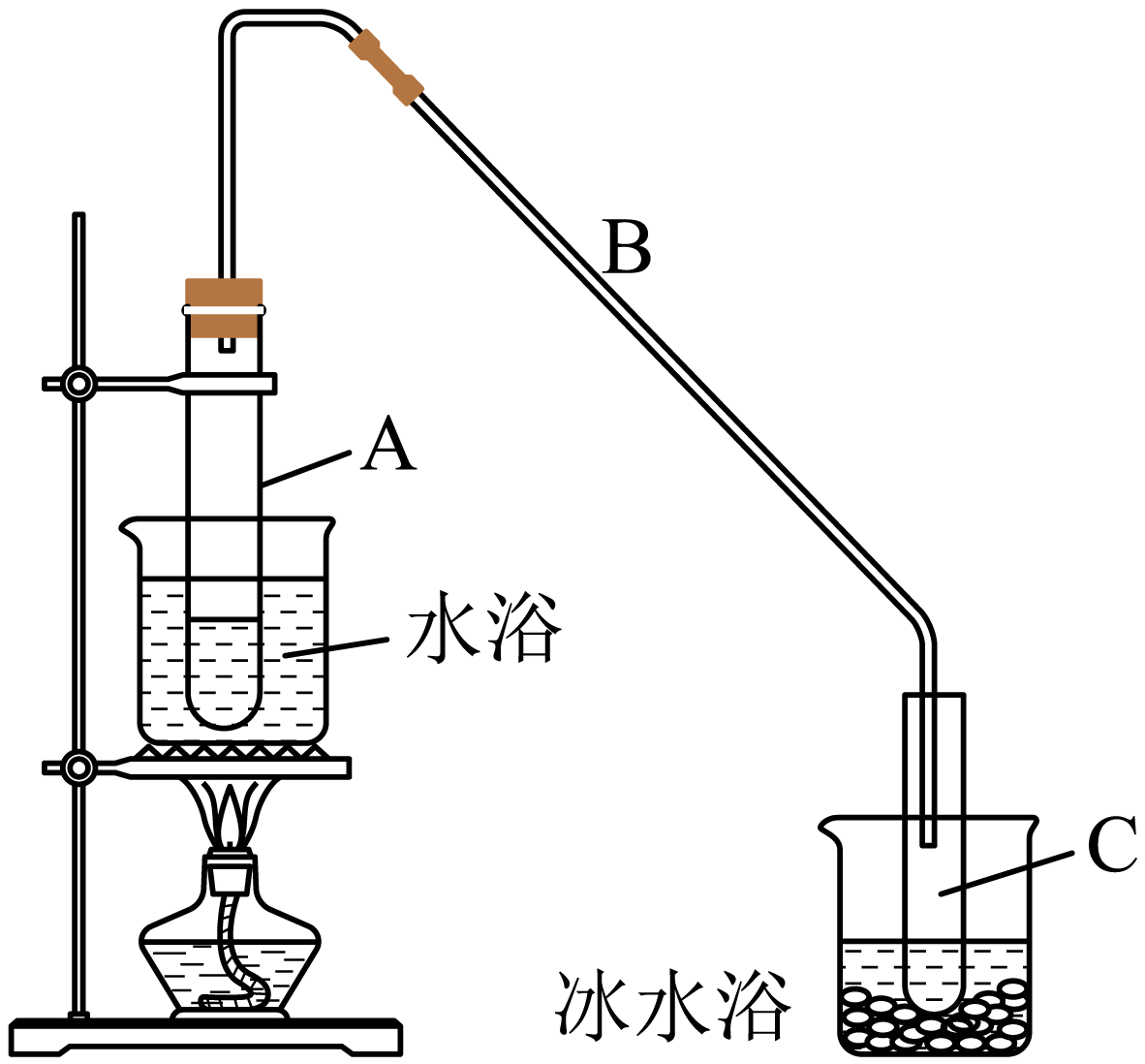
有机化合物的制备是有机化学研究的重要任务之一、某化学小组采用类似制乙酸乙酯的装置如图,以环己醇制备环己烯
已知: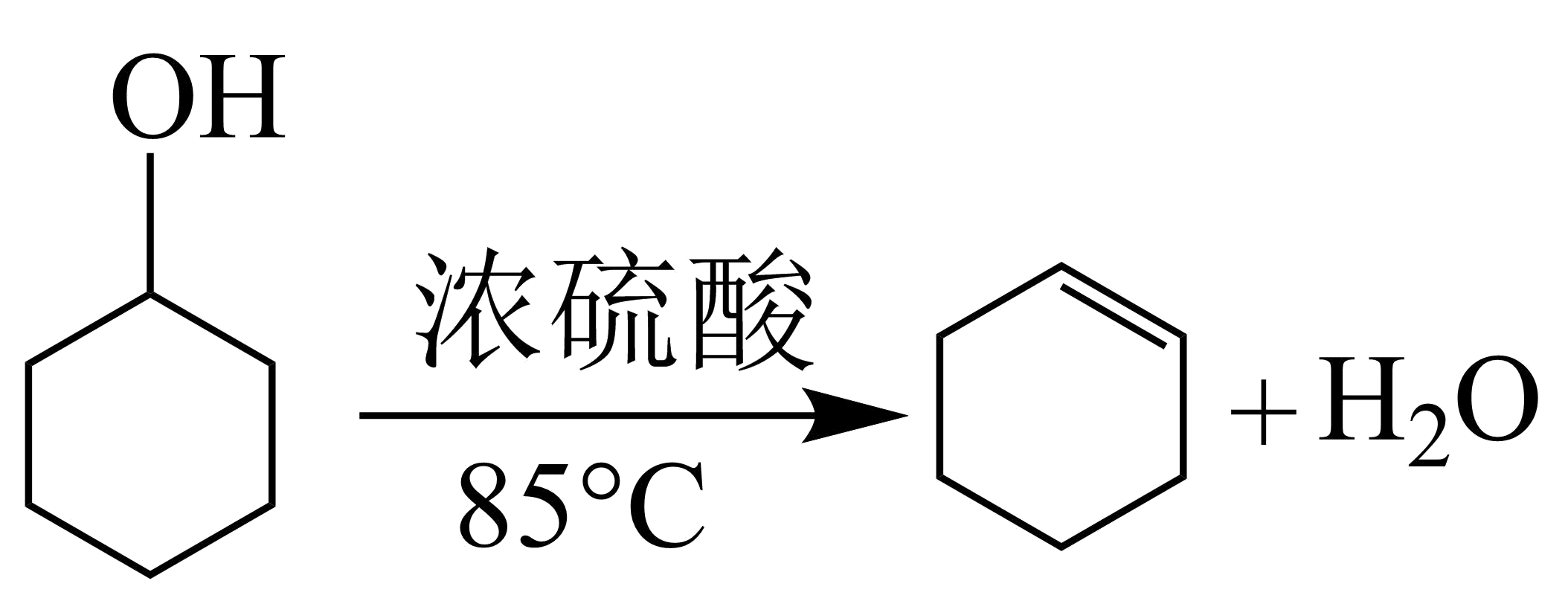
| 密度$\rm (\text{g}/\text{c}{{\text{m}}^{3}}\rm )$ | 熔点$\rm (^\circ\rm C)$ | 沸点$\rm (^\circ\rm C)$ | 溶解性 | |
| 环己醇 | $\rm 0.96$ | $\rm 25$ | $\rm 161$ | 能溶于水 |
| 环己烯 | $\rm 0.81$ | $\rm -103$ | $\rm 83$ | 难溶于水 |
第一步:制备粗品
将$\rm 12.5\;\rm mL$环己醇加入试管$\rm A$中,再加入$\rm 1\;\rm mL$浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管$\rm C$内得到环己烯粗品。
$\rm A$中碎瓷片的作用是 ,导管$\rm B$除了导气外还具有的作用是 。
防暴沸;冷凝
"]]根据制乙烯实验的知识,发生装置$\rm A$中碎瓷片的作用是防止暴沸;导管$\rm B$比较长,能增加与空气的接触面积,除了导气外,其还有的作用是冷凝作用;
试管$\rm C$置于冰水浴中的目的是 。
防止环己烯挥发
"]]试管$\rm C$中冰水浴的目的是降低环己烯蒸气的温度,使其液化;
第二步:制备精品
环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层$\rm ($填上或下$\rm )$,分液后用 $\rm ($填入编号$\rm )$洗涤。
$\rm A$.$\rm \text{KMn}{{\text{O}}_{\text{4}}}$溶液 $\rm B$.稀$\rm {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$ $\rm C$.$\rm \text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$溶液
上;$\\rm C$
"]]环己烯是烃类,不溶于氯化钠溶液,且密度比水小,振荡、静置、分层后环己烯在上层;环己烯中含有碳碳双键,可以被$\rm KMnO_{4}$溶液氧化,稀$\rm H_{2}SO_{4}$不与杂质反应、不能除去酸性杂质,只有$\rm Na_{2}CO_{3}$溶液,不能与环己烯反应,可以与酸性杂质反应,答案选$\rm C$。
再将环己烯按下图装置蒸馏,冷却水从 口进入$\rm ($填写“$\rm g$”或“$\rm f$”$\rm )$。蒸馏时要加入生石灰,目的是 。
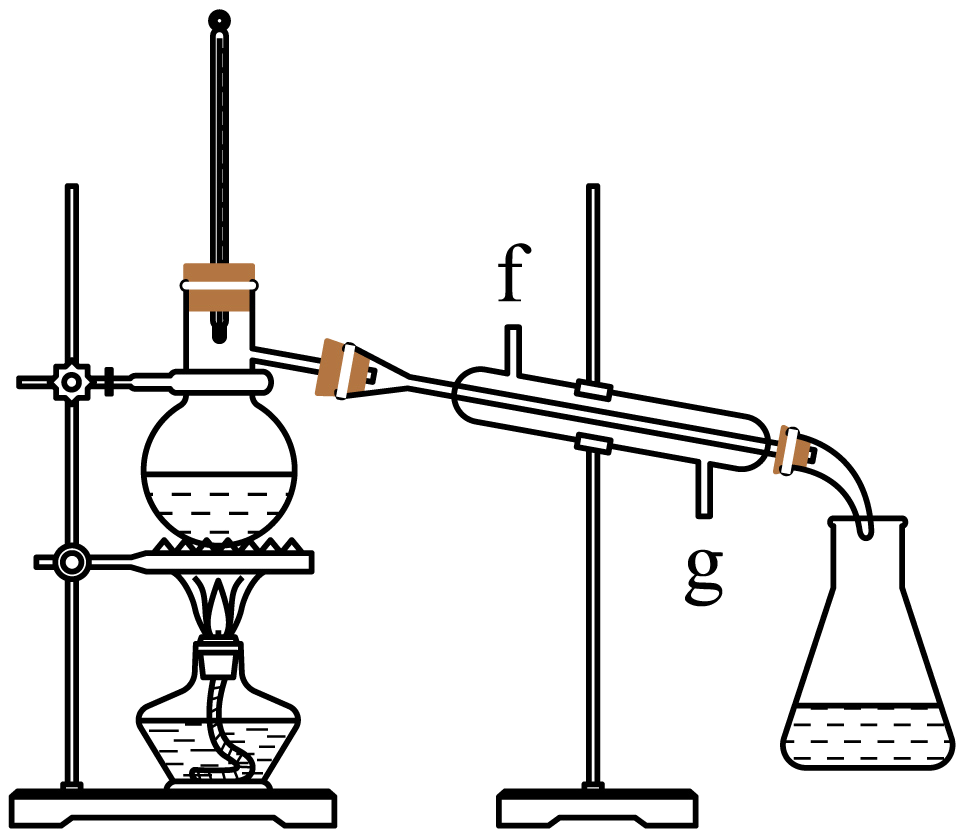
$\\rm g$;吸收水分,便于蒸馏出更纯净的产品
"]]为使气体得到充分冷却,则冷却水从冷凝管的下口即$\rm g$口进入;加入生石灰的目的是为了吸收水分便于蒸馏出更纯净的产品。
收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
$\rm A$.蒸馏时从$\rm 70\;\rm ^\circ\rm C$开始收集产品
$\rm B$.环己醇实际用量多了
$\rm C$.制备粗品时环己醇随产品一起蒸出
$\\rm 83\\;\\rm ^\\circ\\rm C$;$\\rm C$
"]]根据表中数据可知,馏分环己烯的沸点为$\rm 83\;\rm ^\circ\rm C$,故收集产品应控制温度在$\rm 83\;\rm ^\circ\rm C$左右;
$\rm A$.蒸馏时从$\rm 70\;\rm ^\circ\rm C$开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故$\rm A$错误;
$\rm B$.环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,故$\rm B$错误;
$\rm C$.若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,故$\rm C$正确;
故答案选$\rm C$。
高中 | 萃取与分液题目答案及解析(完整版)
