高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
用${{\text{H}}_{2}}{{\text{O}}_{2}}$、$\rm KI$和洗洁精可完成“大象牙膏”实验$\rm ($短时间内产生大量泡沫$\rm )$,某同学依据文献资料对该实验进行探究。
资料$\rm 1$:$\rm KI$在该反应中的作用:${{\text{H}}_{2}}{{\text{O}}_{2}}+{{\text{I}}^{-}}={{\text{H}}_{2}}\text{O}+\text{I}{{\text{O}}^{-}}$;${{\text{H}}_{2}}{{\text{O}}_{2}}+\text{I}{{\text{O}}^{-}}={{\text{H}}_{2}}\text{O}+{{\text{O}}_{2}}\uparrow +{{\text{I}}^{-}}$。
资料$\rm 2$:${{\text{H}}_{2}}{{\text{O}}_{2}}$分解反应过程中能量变化如图所示,其中①有$\rm KI$加入,②无$\rm KI$加入。下列判断正确的是 $\rm ($填字母$\rm )$。
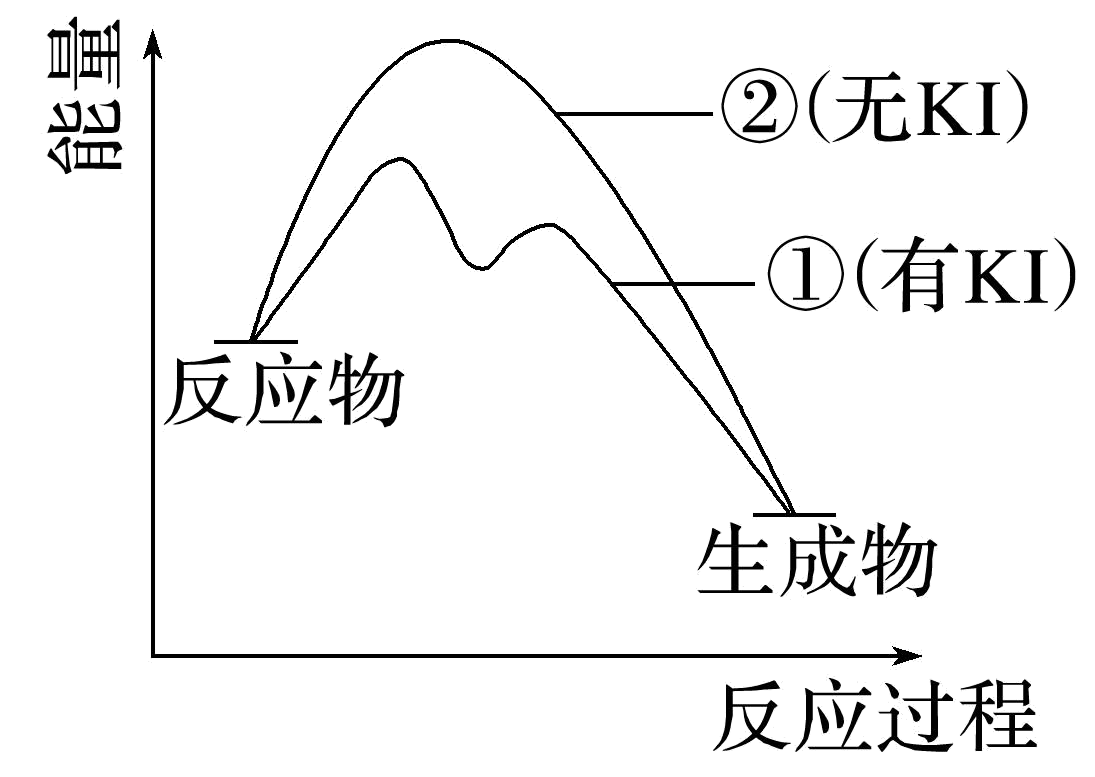
$\rm a$.加入$\rm KI$后改变了反应的路径
$\rm b$.加入$\rm KI$后改变了总反应的能量变化
$\rm c$.$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}+{{\text{I}}^{-}}={{\text{H}}_{2}}\text{O}+\text{I}{{\text{O}}^{-}}$是放热反应
$\\rm a$
"]]$\rm a$.加入$\rm KI$后,一步反应分为两步进行,改变了反应的路径,故$\rm a$项正确;
$\rm b$.由图可知,加入$\rm KI$没有改变反应物的能量与生成物的能量,因此总反应的能量没有变化,故$\rm b$项错误;
$\rm c$.由图可知,第一个抛物线为反应$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}+{{\text{I}}^{-}}={{\text{H}}_{2}}\text{O}+\text{I}{{\text{O}}^{-}}$,生成物的能量大于反应物的能量,因此该反应吸热,故$\rm c$项错误;
答案为$\rm a$;
实验中发现,${{\text{H}}_{2}}{{\text{O}}_{2}}$与$\rm KI$溶液混合后,产生大量气泡,溶液颜色变黄。再加入$\text{CC}{{\text{l}}_{4}}$,振荡、静置,气泡明显减少。
资料$\rm 3$:${{\text{I}}_{2}}$也可催化${{\text{H}}_{2}}{{\text{O}}_{2}}$的分解反应。
①加$\text{CC}{{\text{l}}_{4}}$并振荡、静置后可观察到 ,说明有${{\text{I}}_{2}}$生成。
②气泡明显减少的原因可能是:
$\rm i$.${{\text{H}}_{2}}{{\text{O}}_{2}}$浓度降低;$\rm ii$. 。
以下对照实验说明$\rm i$不是主要原因:
向${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液中加入$\rm KI$溶液,待溶液变黄后,分成两等份于$\rm A$、$\rm B$两试管中。$\rm A$试管中加入$\text{CC}{{\text{l}}_{4}}$,$\rm B$试管中不加$\text{CC}{{\text{l}}_{4}}$,分别振荡、静置。观察到的现象是 。
分层且下层溶液呈紫红色 ; 在水溶液中${{\\text{I}}_{2}}$的浓度降低 ; $\\rm A$试管中产生气泡明显变少;$\\rm B$试管中产生气泡速率没有明显减小
"]]①加$\rm CCl_{4}$并振荡、静置后观察到下层溶液呈紫红色,说明有$\rm I_{2}$生成;
②气泡明显减少的原因还可能在水溶液中$\rm I_{2}$的浓度降低。作为对照,向$\rm H_{2}O_{2}$溶液中加入$\rm KI$溶液,待溶液变黄后,分成两等份于$\rm A$、$\rm B$两试管中。$\rm A$试管加入$\rm CCl_{4}$,$\rm B$试管不加$\rm CCl_{4}$,分别振荡、静置,若$\rm A$试管中产生气泡明显变少,而$\rm B$试管中产生气泡速率没有明显减小则可说明$\rm i$不是主要原因,故选:分层且下层溶液呈紫红色;在水溶液中${{\text{I}}_{2}}$的浓度降低;$\rm A$试管中产生气泡明显变少;$\rm B$试管中产生气泡速率没有明显减小;
资料$\rm 4$:${{\text{I}}^{-}}\left( \text{aq} \right)+{{\text{I}}_{2}}\left( \text{aq} \right)\rightleftharpoons \text{I}_{3}^{-}\left( \text{aq} \right)\quad K=640\text{ mol}\cdot {{\text{L}}^{-1}}$ 。
为了探究体系中含碘微粒的存在形式,进行实验:
向$20\text{ mL}$一定浓度的${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液中加入$10\text{ mL }0.10\text{ mol}\cdot {{\text{L}}^{-1}}\text{ KI}$溶液,达平衡后,相关微粒浓度如下:
| 微粒 | $\mathrm{I}^{-}$ | ${{\text{I}}_{2}}$ | $\text{I}_{3}^{-}$ |
| 浓度$\rm /\left( \text{mol}\cdot {{\text{L}}^{-1}} \right)$ | $2.5\times {{10}^{-3}}$ | $a$ | $4.0\times {{10}^{-3}}$ |
①利用平衡常数求算$a=$ 。
②该平衡体系中除了含有$\mathrm{I}^{-}$、${{\text{I}}_{2}}$、$\text{I}_{3}^{-}$外,一定还含有其他含碘微粒,理由是 。$\rm ($用关系式表达$\rm )$
$2.5\\times {{10}^{-3}}$ ; $2c\\left( {{\\text{I}}_{2}} \\right)+c\\left( {{\\text{I}}^{-}} \\right)+3c\\left( \\text{I}_{3}^{-} \\right)\\lt 0.033\\text{ mol}\\cdot {{\\text{L}}^{-1}}$
"]]①由反应的平衡常数有 $K=\dfrac{4.0\times {{10}^{-3}}}{2.5\times {{10}^{-3}}\times a}\rm =640$,解得$a=2.5\times {{10}^{-3}}$。
②总的碘元素浓度为$\dfrac{10\times {{10}^{-3}}\text{ L}\times \text{0}\text{.1 mol/L}}{\left( 10+20 \right)\times {{10}^{-3}}\text{ L}}=\text{0}\text{.033 mol/L}$,${{\text{I}}_{\text{2}}}、\text{I}_{3}^{-}$和$\mathrm{I}^{-}$中所含碘元素浓度之和为$2c\left( {{\text{I}}_{\text{2}}} \right)+c\left( {{\text{I}}^{-}} \right)+3c(\text{I}_{3}^{-}\rm )=0.0195$ $\rm mol/L\lt 0.033$ $\rm mol/L$,因此溶液一定还含有其他含碘微粒。
高中 | 化学平衡常数题目答案及解析(完整版)
