高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
研究$\text{C}{{\text{O}}_{2}}$与$\text{C}{{\text{H}}_{4}}$的反应对减缓燃料危机和减弱温室效应具有重大意义。
$\text{C}{{\text{O}}_{2}}$与$\text{C}{{\text{H}}_{4}}$发生反应Ⅰ:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta {{H}_{1}}=+234.0\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
在反应过程中还发生反应Ⅱ:${{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons {{\text{H}}_{2}}\text{O}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)\qquad\Delta {{ {H}}_{2}}$
已知部分化学键的键能数据如下:
| 化学键 | $\rm H-O$ | $\rm H-H$ | $\rm C=O$ | $\text{C}\equiv \text{O}$ |
| 键能$\rm (\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\rm )$ | $\rm 413$ | $\rm 436$ | $\rm 803$ | $\rm 1076$ |
则$\Delta {{H}_{2}}=$ 。
$\\rm +140$
"]]根据$\Delta H=$反应物键能和$\rm -$生成物键能和,可知:$\Delta {{H}_{2}}=(436+2\times {803-2}\times {413-1076})\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}=+140\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
在刚性密闭容器中充入一定量的$\text{C}{{\text{O}}_{2}}$与$\text{C}{{\text{H}}_{4}}$,下列能判断反应$\text{I}$达到平衡状态的是$(\quad\ \ \ \ )\rm ($填标号$\rm )$。
在绝热容器中,温度保持不变
","恒温时,混合气体的密度保持不变
","恒温时,混合气体中$\\text{C}{{\\text{O}}_{2}}$与$\\text{C}{{\\text{H}}_{4}}$的物质的量浓度相等
","恒温时,${{\\text{H}}_{2}}\\left( \\text{g} \\right)$和${{\\text{H}}_{2}}\\text{O}\\left( \\text{g} \\right)$的物质的量之和保持不变
"]$\rm A$.该反应为吸热反应,在绝热容器中,随反应正向进行,体系内温度降低,当温度保持不变时,可知反应达到平衡状态,故$\rm A$选;
$\rm B$.体系内只有气体物质,气体总质量恒定,容器体积不变,则混合气体的密度始终恒定,不能据此判断平衡状态,故$\rm B$不选;
$\rm C$.恒温时,混合气体中$\text{C}{{\text{O}}_{2}}$与$\text{C}{{\text{H}}_{4}}$的物质的量浓度相等,不能说明各组分浓度保持不变,不能据此判断平衡状态,故$\rm C$不选;
$\rm D$.反应Ⅱ中氢气和水的物质的量之和恒定,反应Ⅰ中氢气的物质的量逐渐增加,则体系内${{\text{H}}_{2}}\left( \text{g} \right)$和${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$的物质的量之和保持不变时,说明反应Ⅰ中氢气的生成量与消耗量相等,则反应达到平衡状态,故$\rm D$选;
故选:$\rm AD$。
将$\text{C}{{\text{H}}_{4}}$与$\text{C}{{\text{O}}_{2}}$按物质的量之比$\rm 1: 1$投料时,$\text{C}{{\text{H}}_{4}}$和$\text{C}{{\text{O}}_{2}}$的平衡转化率随温度变化关系如图所示。
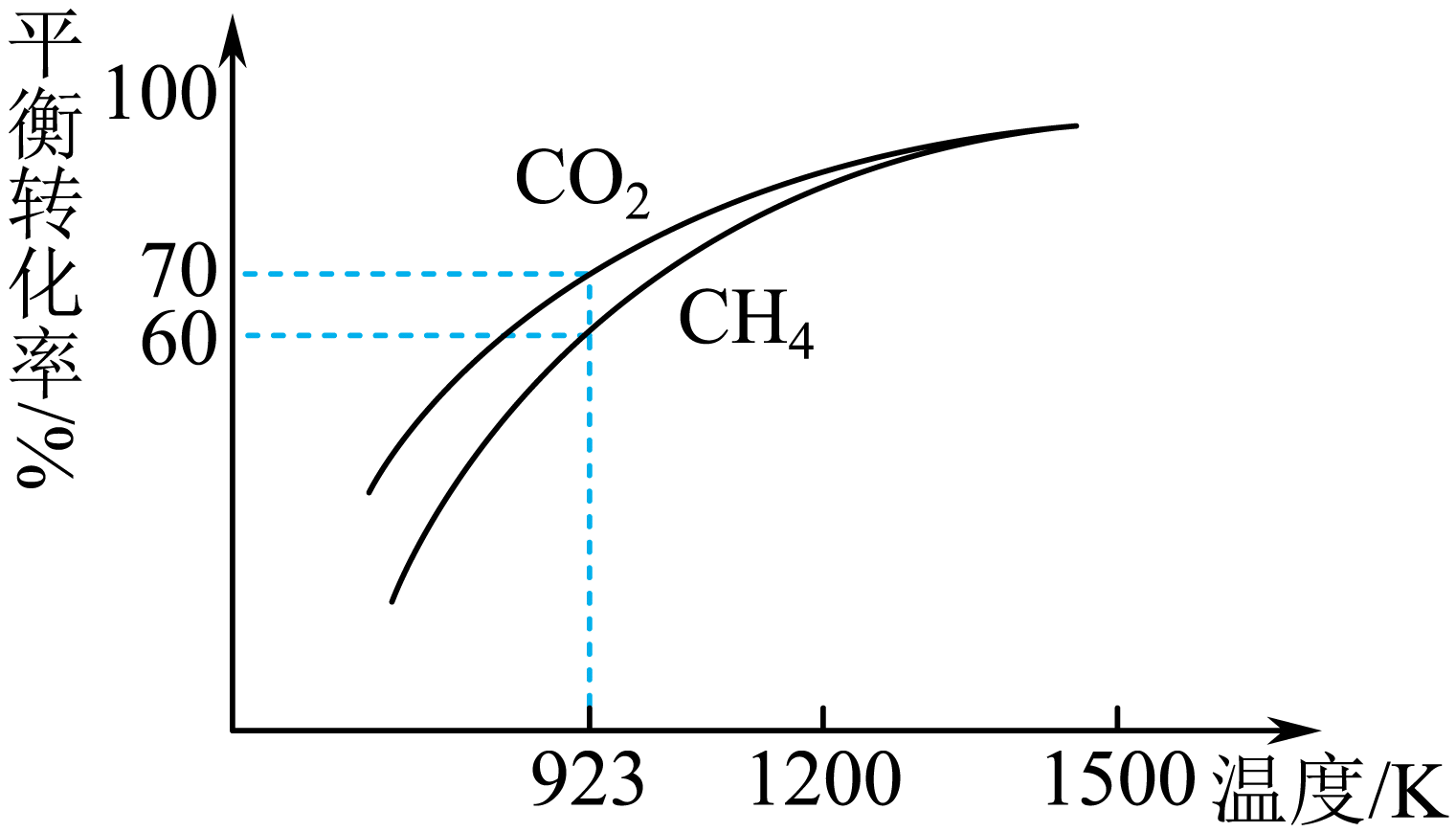
①$\rm 923\;K$时,$\text{C}{{\text{O}}_{2}}$的平衡转化率大于$\rm CH_{4}$的原因是 。
②$\rm 923\;K$时,反应Ⅱ的化学平衡常数$ {K=}$ $\rm ($计算结果保留小数点后两位$\rm )$。
③$\rm 923\;K$时,投入$\text{C}{{\text{H}}_{4}}$与$\text{C}{{\text{O}}_{2}}$的物质的量均为$\rm 1\;\rm mol$,求此时体系内吸收的总热量 $\rm \;\rm kJ$。
反应$\\text{I}$中$\\text{C}{{\\text{O}}_{2}}$和$\\text{C}{{\\text{H}}_{4}}$的转化率相同,$\\text{C}{{\\text{O}}_{2}}$又发生反应Ⅱ,转化率增大;$\\rm 0.39$;$\\rm 154.4$
"]]①$\rm 923\;K$时,$\text{C}{{\text{O}}_{2}}$的平衡转化率大于$\rm CH_{4}$的原因是反应$\text{I}$中$\text{C}{{\text{O}}_{2}}$和$\text{C}{{\text{H}}_{4}}$的转化率相同,$\text{C}{{\text{O}}_{2}}$又发生反应Ⅱ,转化率增大;
②设起始时$\text{C}{{\text{H}}_{4}}$与$\text{C}{{\text{O}}_{2}}$的物质的量均为$\rm 1\;\rm mol$,结合已知条件列三段式:
$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{2CO}\left( \text{g} \right) & + & \text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\ 起始\text{/mol} & 1 & {} & 1 & {} & 0 & {} & 0 \\转化 \text{/mol} & 0.6 & {} & 0.6 & {} & 1.2 & {} & 1.2 \\平衡 \text{/mol} & 0.4 & {} & {} & {} & {} & {} & {} \\ \end{matrix}$
$\begin{matrix} {} & {{\text{H}}_{2}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\ 起始\text{/mol} & {} & {} & {} & {} & {} & {} & {} \\转化 \text{/mol} & 0.1 & {} & 0.1 & {} & 0.1 & {} & 0.1 \\ 平衡\text{/mol} & {} & {} & {} & {} & {} & {} & 0.1 \\ \end{matrix}$
平衡时$n\rm (CO_{2})=0.3\;\rm mol$;$n\rm (CO)=1.2\;\rm mol+0.1\;\rm mol=1.3\;\rm mol$;$n\rm (H_{2})=1.2\;\rm mol-0.1\;\rm mol=1.1\;\rm mol$;$n\rm (H_{2}O)=0.1\;\rm mol$,$K_{ Ⅱ }=\dfrac{\dfrac{ {n(}{{\text{H}}_{\text{2}}}\text{O)}}{V}\cdot \dfrac{ {n\rm (CO)}}{V}}{\dfrac{ {n(}{{\text{H}}_{\text{2}}}\text{)}}{V}\cdot \dfrac{ {n\rm (C}{{\text{O}}_{2}}\text{)}}{V}}=\dfrac{1.3\times 0.1}{1.1\times 0.3}\approx 0.39$;
③$\rm 923\;K$时,投入$\text{C}{{\text{H}}_{4}}$与$\text{C}{{\text{O}}_{2}}$的物质的量均为$\rm 1\;\rm mol$,根据以上分析可知反应Ⅰ吸收的热量为$+234.0\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times 0.6\text{ mol=140}\text{.4 kJ}$;反应Ⅱ吸收的热量为$+140.0\ \text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times 0.1\text{ mol=14 kJ}$,此时体系内吸收的总热量$\rm 140.4\;\rm kJ+14\;\rm kJ=154.4\;\rm kJ$。
以表面覆盖$\rm \text{C}{{\text{u}}_{2}}\text{A}{{\text{l}}_{2}}{{\text{O}}_{4}}$的二氧化钛为催化剂,可以将$\rm \text{C}{{\text{O}}_{2}}$和$\rm \text{C}{{\text{H}}_{4}}$直接转化成乙酸。
①为了提高该反应中$\rm \text{C}{{\text{H}}_{4}}$的平衡转化率,可以采取的措施是 $\rm ($任写一种$\rm )$。
②催化剂在该反应中的作用是 $\rm ($填标号$\rm )$。
$\rm A$.降低反应的活化能 $\rm B$.降低反应的焓变 $\rm C$.改变反应的历程 $\rm D$.增大反应的平衡常数$ {K}$
增大浓度、增大压强等;$\\rm AC$
"]]①为了提高该反应中$\rm \text{C}{{\text{H}}_{4}}$的平衡转化率,应使反应平衡正向移动,结合反应特征,可采取的措施有增大压强或增大$\rm \text{C}{{\text{O}}_{2}}$的浓度等措施;
②催化剂在该反应中可以降低反应的活化能,改变反应的历程,从而能加快反应速率,但对焓变和平衡常数无影响,故$\rm AC$正确。
高中 | 化学平衡常数题目答案及解析(完整版)
