高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
科学家正在研究利用催化技术将尾气中的$\text{NO}$和$\text{CO}$转变成$\text{C}{{\text{O}}_{2}}$和${{\text{N}}_{2}}$,化学方程式如下:$\text{2NO}+2\text{CO}\rightleftharpoons 2\text{C}{{\text{O}}_{\text{2}}}+{{\text{N}}_{2}}\quad \Delta H\lt 0$。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的$\text{NO}$和$\text{CO}$浓度如表:
| 时间$/\text{s}$ | $\rm 0$ | $\rm 1$ | $\rm 2$ | $\rm 3$ | $\rm 4$ | $\rm 5$ |
| $c\left( \text{NO} \right)\left( \times {{10}^{-4}}\,\text{mol}\cdot {{\text{L}}^{-1}} \right)$ | $\rm 10.0$ | $\rm 4.50$ | $\rm 2.50$ | $\rm 1.50$ | $\rm 1.00$ | $\rm 1.00$ |
| $c\left( \text{CO} \right)\left( \times {{10}^{-3}}\,\text{mol}\cdot {{\text{L}}^{-1}} \right)$ | $\rm 3.60$ | $\rm 3.05$ | $\rm 2.85$ | $\rm 2.75$ | $\rm 2.70$ | $\rm 2.70$ |
请回答下列问题$\rm ($均不考虑温度变化对催化剂催化效率的影响$\rm )$:
①前$2\text{ s}$内的平均反应速率$v\left( {{\text{N}}_{\text{2}}} \right)=$ 。
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高$\text{NO}$转化率的是 。
$\rm A$.选用更有效的催化剂 $\rm B$.升高反应体系的温度
$\rm C$.降低反应体系的温度 $\rm D$.缩小容器的体积
$\\rm 1.875\\times 10^{-4}$ $\\rm mol·L^{-1}·s^{-1}$ ; $\\rm CD$
"]]①根据表中数据,$\rm 2$ $\rm s$内的平均反应速率$v\left( \text{NO} \right)=\dfrac{1.00\times {{10}^{-3}}-2.50\times {{10}^{-4}}}{2}=3.75\times {{10}^{-4}}\text{ mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}$,同一反应不同物质表示的速率比值等于系数之比,则$v\left( {{\text{N}}_{\text{2}}} \right)=\dfrac{1}{2}v\left( \text{NO} \right)=1.875\times {{10}^{-4}}\text{ mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}$;
②$\rm A$.选用更有效的催化剂,缩短达到平衡的时间,平衡不移动,不能提高$\rm NO$转化率,不符合题意;
$\rm B$.该反应$\Delta H\lt 0$ ,故升高反应体系的温度,平衡逆向移动,不能提高$\rm NO$转化率,不符合题意;
$\rm C$.该反应$\Delta H\lt 0$ ,降低反应体系的温度,平衡正向移动,能提高$\rm NO$转化率,符合题意;
$\rm D$.缩小容器的体积,平衡朝体积减小方向移动,即正向移动,能提高$\rm NO$转化率,符合题意;
已知:$\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{2S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\quad \Delta H=-196.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$\text{2NO}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{2N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta H=-113.0\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
①则反应$\text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)+\text{NO}\left( \text{g} \right)$的$\Delta H=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
②一定条件下,将$\rm NO_{2}$与$\rm SO_{2}$以体积比$\rm 1$:$\rm 2$置于密闭容器中发生上述反应,测得上述反应平衡时$\text{N}{{\text{O}}_{\text{2}}}$与$\text{S}{{\text{O}}_{\text{2}}}$体积比为$1:6$,则平衡常数$K=$ 。
$-41.8$ ; $\\dfrac{8}{3}$
"]]已知:$\text{a}:2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{S}{{\text{O}}_{3}}\left( \text{g} \right)\quad \Delta H=-196.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$\text{b}:2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta H=-113.0\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,利用盖斯定律将$\text{a}\times \dfrac{1}{2}-\text{b}\times \dfrac{1}{2}$得
①$\text{N}{{\text{O}}_{2}}\left( \text{g} \right)+\text{S}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{S}{{\text{O}}_{3}}\left( \text{g} \right)+\text{NO}\left( \text{g} \right)\quad \Delta H=\dfrac{1}{2}\times \left( -196.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)-\dfrac{1}{2}\times \left( -113.0\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)=-41.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
③设起始$\text{N}{{\text{O}}_{2}}$的体积为$a$,则$\text{S}{{\text{O}}_{2}}$的体积为$2a$,平衡时生成的$\rm NO$的体积为$x$, $\begin{matrix} {} & \text{N}{{\text{O}}_{2}}\left( \text{g} \right) & + & \text{S}{{\text{O}}_{2}}\left( \text{g} \right) \\ 起始体积{} & a & {} & 2a \\转化体积 {} & x & {} & x \\ 平衡体积{} & a-x & {} & 2a-x \\\end{matrix}\begin{matrix} \rightleftharpoons & \text{S}{{\text{O}}_{3}}\left( \text{g} \right) & + & \text{NO}\left( \text{g} \right) \\ {} & 0 & {} & 0 \\ {} & x & {} & x \\ {} & x & {} & x \\\end{matrix}$平衡时$\text{N}{{\text{O}}_{2}}$与$\text{S}{{\text{O}}_{2}}$体积比为$\rm 1$:$\rm 6$,即$\left( a-x \right):\left( 2a-x \right)=1:6$,故$x=0.8a$,故平衡常数$K=\dfrac{c\left( \text{S}{{\text{O}}_{3}} \right)c\left( \text{NO} \right)}{c\left( \text{N}{{\text{O}}_{2}} \right)c\left( \text{S}{{\text{O}}_{2}} \right)}=\dfrac{{{x}^{2}}}{\left( a-x \right)\left( 2a-x \right)}=\dfrac{{{(0.8a)}^{2}}}{0.2a\times 1.2a}=\dfrac{8}{3}$;
如图是一种用$\text{N}{{\text{H}}_{\text{3}}}$、${{\text{O}}_{\text{2}}}$脱除烟气中$\text{NO}$的原理,该原理中$\text{NO}$最终转化为${{\text{H}}_{\text{2}}}\text{O}$和 $\rm ($填化学式$\rm )$,当消耗$\text{2}\ \text{mol}\,\text{N}{{\text{H}}_{\text{3}}}$和$\text{0}\text{.5}\ \text{mol}\,{{\text{O}}_{\text{2}}}$时,除去的$\text{NO}$在标准状况下的体积为 $\text{L}$。
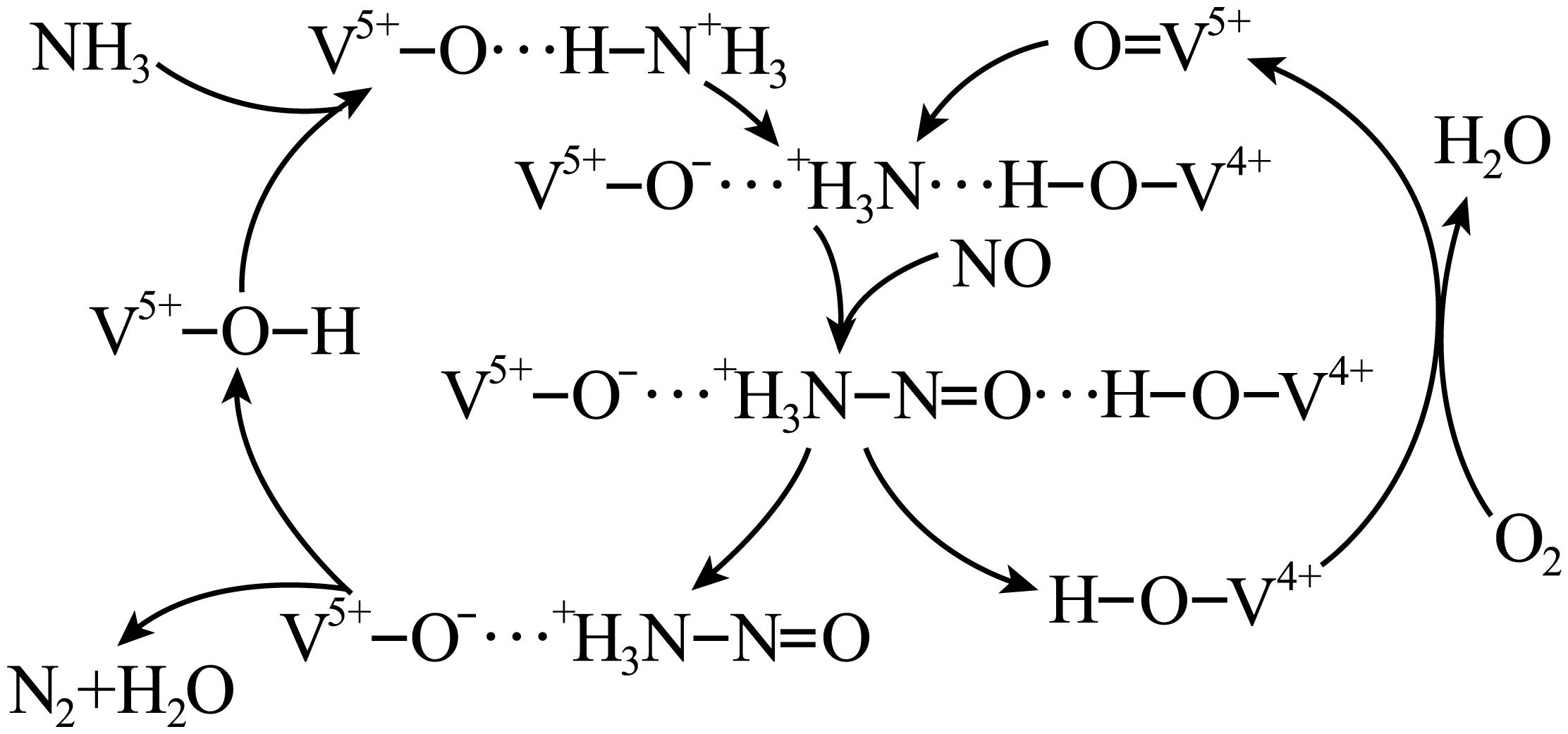
$\\rm N_{2}$ ; $\\rm 44.8$
"]]由图可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以$\rm NO$最终转化为$\rm N_{2}$和$\rm H_{2}O$;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于$\rm NO$和氧气得到的电子总物质的量,$\rm 2$ $\rm mol$ $\rm NH_{3}$转化为$\rm N_{2}$失去$\rm 6$ $\rm mol$电子,$\rm 0.5$ $\rm mol$ $\rm O_{2}$得到$\rm 2$ $\rm mol$电子,则$\rm NO$转化为$\rm N_{2}$得到的电子为$\rm 4$ $\rm mol$,所以$\rm NO$的物质的量为$\rm 2$ $\rm mol$,其标况下体积为$\rm 44.8$ $\rm L$;
高中 | 化学平衡常数题目答案及解析(完整版)
