高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
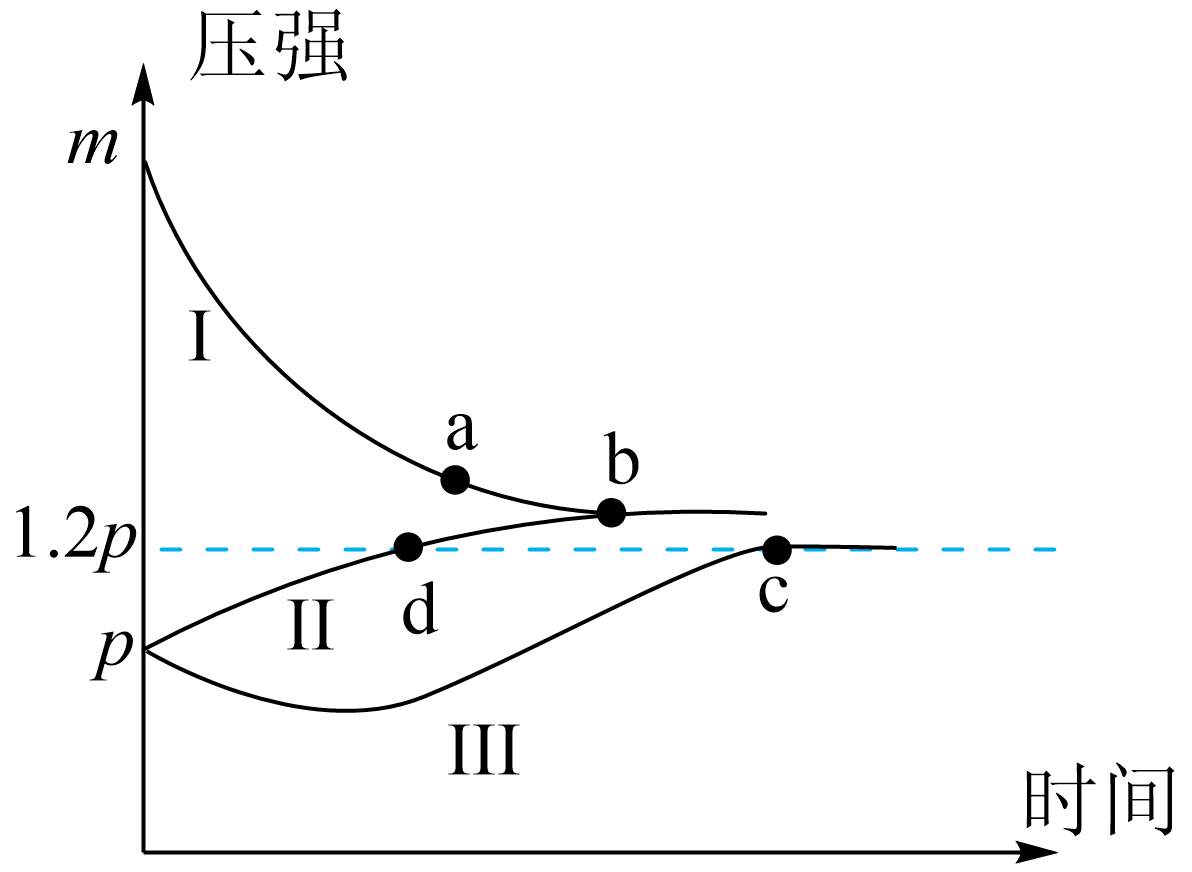
一定条件下,分别向体积为$1\ \text{L}$的密闭容器中充入气体,发生反应:$\text{X}\left( \text{g} \right)+\text{Y}\left( \text{g} \right)\rightleftharpoons \text{Z}\left( \text{g} \right)$,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法不正确的是$(\qquad)$
| 实验 | 充入气体量 | 反应过程条件 |
| ① | $\rm 1\;\rm mol\;\rm X+1\;\rm mol\;\rm Y$ | 恒温 |
| ② | $\rm 1\;\rm mol\;\rm Z$ | 恒温 |
| ③ | $\rm 1\;\rm mol\;\rm Z$ | 绝热 |
曲线$\\rm I$对应实验①
","正反应为放热反应
","气体的总物质的量:${{ {n}}_{\\text{c}}}\\lt {{ {n}}_{\\text{d}}}$
","$\\rm c$点的平衡常数:${ {K}}_{\\mathrm{c}} \\gt {0.05}$
"]$\rm A$.恒温恒容条件下,气体的压强之比等于气体物质的量之比,故起始时实验②与实验③的压强相等,实验①的压强是实验②与实验③的$\rm 2$倍,则曲线Ⅰ对应实验①,$\rm A$正确;
$\rm B$.实验①与实验②的温度相等,根据等效平衡可知,实验①与实验②最终会达到相同的平衡状态,故曲线$\rm II$对应实验②,则曲线$\rm III$对应实验③,实验②与实验③充入的$\rm Z$一样多,实验③比实验②达到平衡所用的时间长,则实验③温度较低,反应速率较慢,说明$\text{Z}\left( \text{g} \right)\rightleftharpoons \text{X}\left( \text{g} \right)+\text{Y}\left( \text{g} \right)$是吸热反应,则正反应为放热反应,$\rm B$正确;
$\rm C$.根据$pV=nRT$,$\rm c$、$\rm d$两点的压强相同,$ V$相同,由于从逆向建立平衡,逆向是吸热,$\rm c$点的温度比$\rm d$点低,则$\rm c$点的气体物质的量更多,故气体的总物质的量:${{ {n}}_{\text{c}}}\gt {{ {n}}_{\text{d}}}$,$\rm C$错误;
$\rm D$.绝热条件下,设$c$点达到平衡时$\rm Z$转化了$x\;\rm mol$,可列出三段式:
$\begin{matrix} {} \\ 起始\text{(mol)} \\ 转化\text{(mol)} \\平衡 \text{(mol)} \\ \end{matrix}\begin{matrix} \text{Z(g)}\rightleftharpoons \\ \text{1} \\ {x} \\ {1-x} \\ \end{matrix}\begin{matrix} \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{Y(g)} \\ \text{0} \\ {x} \\ {x} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{X(g)} \\ \text{0} \\ {x} \\ {x} \\ \end{matrix}$
则$\dfrac{ {1-x+x+x}}{1}=\dfrac{1.2 {p}}{ {p}}$,$x=0.2$,故$K_{\rm c}=\dfrac{0.2\times 0.2}{1-0.2}=0.05$,$\text{Z}\left( \text{g} \right)\rightleftharpoons \text{X}\left( \text{g} \right)+\text{Y}\left( \text{g} \right)$反应为吸热反应,此时温度低于恒温时的温度,升温平衡正向移动,$K$增大,故恒温条件下:${ {K}}_{\mathrm{c}} \gt {0.05}$,$\rm D$正确。
故选:$\rm C$
高中 | 化学平衡常数题目答案及解析(完整版)
