高中 | 原电池原理的应用 题目答案及解析
稿件来源:高途
高中 | 原电池原理的应用题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池原理的应用
能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,水分解断裂的化学键是 $\rm ($填“离子键”或“共价键”$\rm )$。
共价键
"]]水是共价化合物,分子中只存在共价键,则水分解时断裂的化学键是共价键;
下列化学反应在理论上可以设计成原电池的是$(\quad\ \ \ \ )\rm ($填字母$\rm )$。
$\\text{Fe}+2\\text{FeC}{{\\text{l}}_{3}}=3\\text{FeC}{{\\text{l}}_{2}}$
","$2 \\mathrm{NaOH}+\\mathrm{CO}_{2}=\\mathrm{Na}_{2} \\mathrm{CO}_{3}+\\mathrm{H}_{2} \\mathrm{O}$
","$\\text{C}+{{\\text{H}}_{2}}\\text{O}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{CO}+{{\\text{H}}_{2}}$
","$\\text{Ba}{{\\left( \\text{OH} \\right)}_{2}}+{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}=\\text{BaS}{{\\text{O}}_{4}}\\downarrow +2{{\\text{H}}_{2}}\\text{O}$
"]根据原电池的形成条件可知,必须是自发进行的氧化还原反应才可能从理论上将其设计为原电池;
$\rm A$.$\rm Fe+2FeCl_{3}=3FeCl_{2}$是一个自发进行的氧化还原反应,可以设计为原电池,$\rm A$符合题意;
$\rm B$.$2 \mathrm{NaOH}+\mathrm{CO}_{2}=\mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O}$是一个自发进行的非氧化还原反应,不可以设计成原电池,$\rm B$错误;
$\rm C$.$\text{C}+{{\text{H}}_{2}}\text{O}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{CO}+{{\text{H}}_{2}}$是一个非自发进行的氧化还原反应,不可以设计为原电池,$\rm C$错误;
$\rm D$.$\text{Ba}{{\left( \text{OH} \right)}_{2}}+{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}=\text{BaS}{{\text{O}}_{4}}\downarrow +2{{\text{H}}_{2}}\text{O}$是一个自发进行的非氧化还原反应,不可以设计成原电池, $\rm D$错误;
故选:$\rm A$;
如图为某燃料电池的结构示意图,电解质溶液为$\rm NaOH$溶液,电极材料为疏松多孔的石墨棒。回答下列问题:
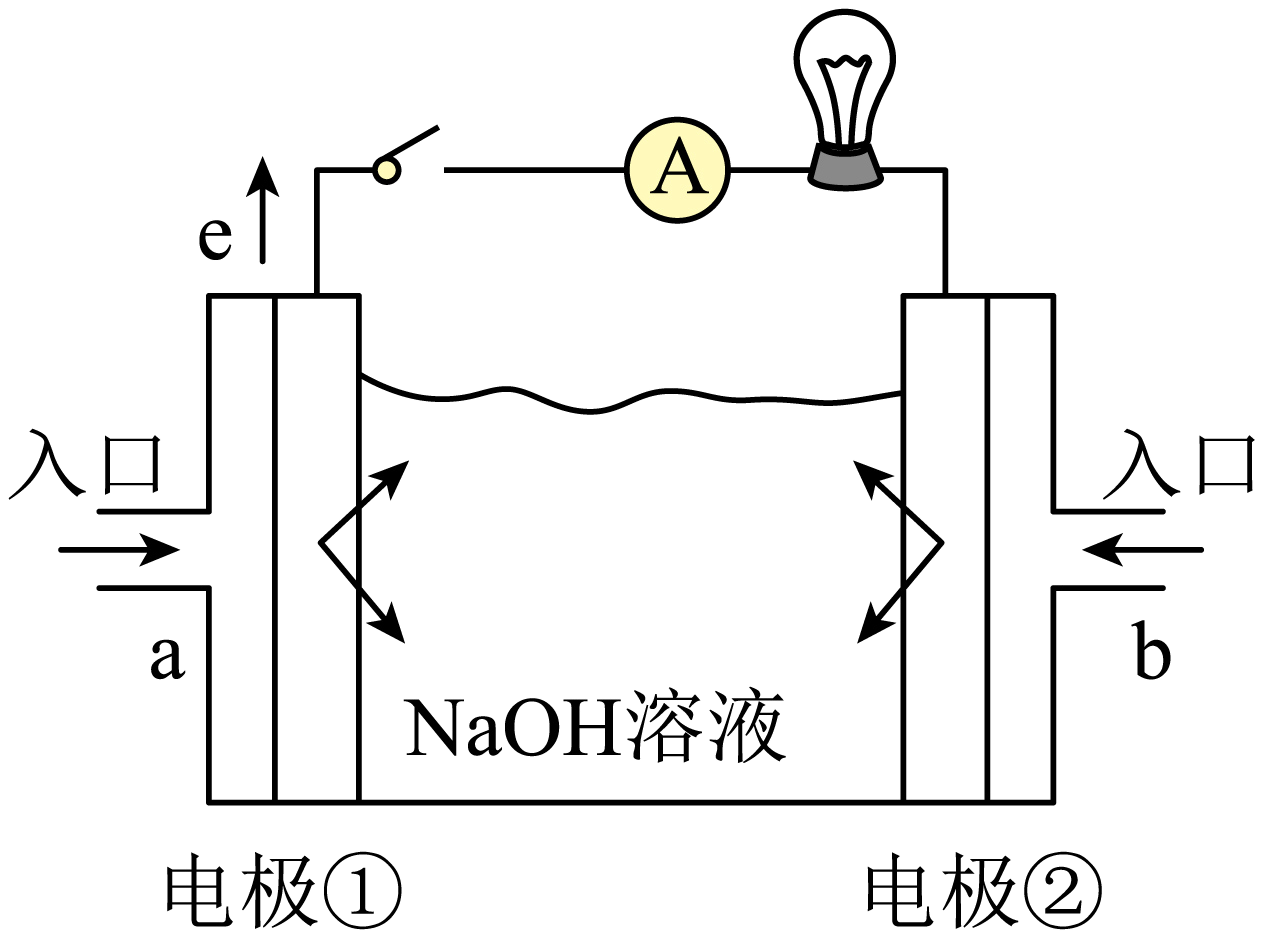
若该燃料电池为氢氧燃料电池。
①$\rm a$极通入的物质为 $\rm ($填物质名称$\rm )$,电解质溶液中的$\rm OH^{-}$移向 $\rm ($“负”或“正”$\rm )$。
②写出此氢氧燃料电池工作时总反应方程式: 。
氢气 ;负 ;${{\\text{O}}_{\\text{2}}}\\text{+2}{{\\text{H}}_{\\text{2}}}=\\text{2}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]①由电子流向可知,$\rm a$极为负极,通入的物质为氢气,氢气失去电子发生氧化反应;原电池中阴离子向负极迁移,故电解质溶液中的$\rm OH^{-}$移向负极。
②氢氧燃料电池工作时总反应方程式:${{\text{O}}_{\text{2}}}\text{+2}{{\text{H}}_{\text{2}}}=\text{2}{{\text{H}}_{\text{2}}}\text{O}$。
高中 | 原电池原理的应用题目答案及解析(完整版)
