高中 | 原电池原理的应用 题目答案及解析
稿件来源:高途
高中 | 原电池原理的应用题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池原理的应用
能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用,人们根据原电池原理可制作不同的电池以满足不同的需求,请回答下列问题:
下列有关电池的说法正确的是$(\quad\ \ \ \ )$(填标号)。
氢氧燃料电池属于二次电池
","原电池的电极材料不一定是金属材料
","电能属于二次能源
","所有的氧化还原反应均能设计为原电池
"]A.氢氧燃料电池放电后,不能通过充电的方式使 其复原,不属于二次电池,故A错误;
B.原电池的电极材料不一定是金属材料,也可以是石墨等,故B正确;
C.二次能源是由一次能源经过加工或转化得到的能源,电能通常由其它能源(如煤炭等一次能源)转化而来,属于二次能源,故C正确;
D.不是所有的氧化还原反应均能设计为原电池,必须是自发进行的氧化还原反应,故D错误;
故选BC;
依据原电池的形成条件,现有反应$\rm 2NaOH+{{H}_{2}}S{{O}_{4}}=N{{a}_{2}}S{{O}_{4}}+2{{H}_{2}}O$,该反应 (填“能”或“不能”)设计成原电池,原因是 。
不能; 该反应不是氧化还原反应(或其他合理答案)
"]]自发进行的氧化还原反应才能设计成原电池,则反应$\rm 2NaOH+{{H}_{2}}S{{O}_{4}}=N{{a}_{2}}S{{O}_{4}}+2{{H}_{2}}O$,不能设计成原电池,原因是:该反应不是氧化还原反应;
$\rm FeC{{l}_{3}}$溶液可用于腐蚀电路板,其反应原理为$\rm 2FeC{{l}_{3}}+Cu=2FeC{{l}_{2}}+CuC{{l}_{2}}$,若将其设计为原电池,则所用负极材料为 (填化学式),正极的电极反应式为 。
$\\rm Cu$ ;$\\rm F{{e}^{3+}}+{{e}^{-}}=F{{e}^{2+}}$
"]]该反应的离子方程式为 $\rm Cu+2Fe^{3+}=2Fe^{2+}+Cu^{2+}$,铜失去电子,若将该反应设计为原电池,则所用负极材料为$\rm Cu$,正极上发生还原反应,则正极反应式为$\rm Fe^{3+}+e^{-}=$ $\rm Fe^{2+}$;
利用微生物燃料电池原理,科学家设计了可以将航天员排出的粪便转化为无污染物质,同时得到电能的原电池,其原理如图所示(图中膜为质子交换膜,只允许$\rm {{H}^{+}}$通过)。
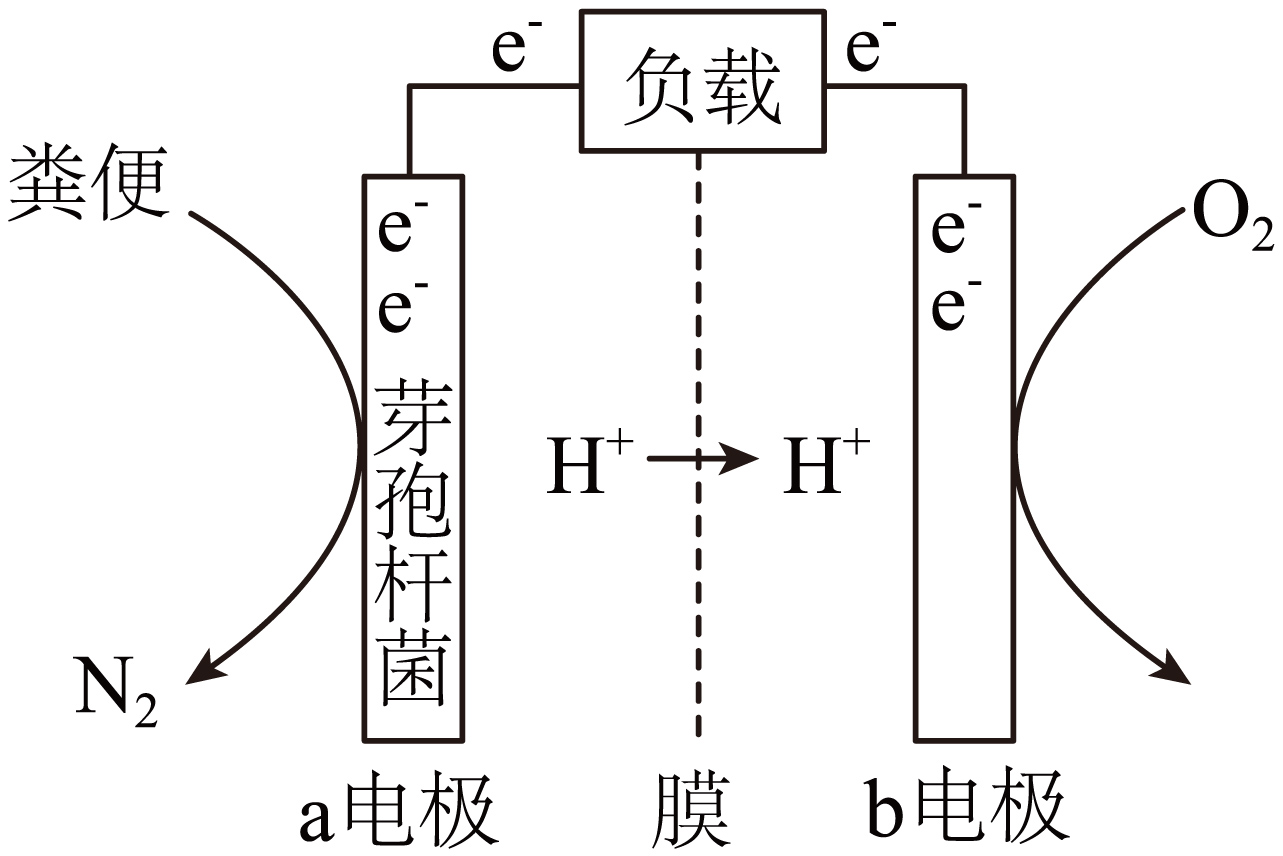
① $\rm a$电极为 (填“正”或“负”)极。
② $\rm b$电极上的电极反应式为 。
③ 电路中每转移$\rm 0.4{\textit{N}_{A}}$个电子,不考虑水分子的移动,理论上$\rm b$电极区溶液增重 $\rm \;\rm g$。
负; $\\rm {{O}_{2}}+4{{e}^{-}}+4{{H}^{+}}=2{{H}_{2}}O$; $\\rm 3.6$
"]]① 结合图示可知,氧气在$\rm b$电极得到电子,则$\rm b$电极为正极,$\rm a$电极为负极;
② $\rm b$电极上氧气得到电子,电解质为酸性环境,则$\rm b$电极上的电极反应式为$\rm {{O}_{2}}+4{{e}^{-}}+4{{H}^{+}}=2{{H}_{2}}O$;
③ 结合② 的分析可知,$\rm b$电解的反应式为:$\rm {{O}_{2}}+4{{e}^{-}}+4{{H}^{+}}=2{{H}_{2}}O$,$\rm b$电极区溶液增加的质量是生成水的质量,电路中每转移$\rm 0.4{\textit {N}_{A}}$个电子时,生成$\rm 0.2\;\rm mol$水,即增重$\rm 0.2\;\rm mol\times 18\;\rm g/mol=3.6\;\rm g$。
高中 | 原电池原理的应用题目答案及解析(完整版)
