高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
将$100\text{ mL }0.5\text{ mol}\cdot {{\text{L}}^{-1}}$盐酸与$100\text{ mL }0.55\text{ mol}\cdot {{\text{L}}^{-1}}\text{ NaOH}$溶液在量热计中进行中和反应(可将稀酸、稀碱的密度近似与水的密度相等,生成溶液的比热容$C=4.18\rm\text{ J}\cdot \text{g}{{}^{-1}}\cdot {{K}^{-1}}$)。
写出该实验反应的离子方程式 。
$\\rm H^{+}+OH^{-}=H_{2}O$
"]]盐酸和$\rm NaOH$溶液反应生成$\rm NaCl$和水,反应的离子方程式$\rm H^{+}+OH^{-}=H_{2}O$;
已知反应吸收或者放出的热量可用公式${Q}= {cm}\Delta {T}$计算,若温度计示数从$\rm 25.0\;\rm ^\circ\rm C$升高到$\rm 28.4\;\rm ^\circ\rm C$,中和反应的反应热$\Delta H=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。$\rm ($保留一位小数$\rm )$
$-56.8$
"]]$100\;\rm \text{mL}\;\rm 0.5\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$盐酸与$100\;\rm \text{mL}\;\rm 0.55\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ NaOH}$溶液反应盐酸完全反应,生成$n\rm (H_{2}O)=0.5\;\rm mol/L\times 0.1\;\rm L=0.05\;\rm mol$,若温度计示数从$\rm 25.0\;\rm ^\circ\rm C$升高到$\rm 28.4\;\rm ^\circ\rm C$,放出的热量${Q}={cm}\Delta {T}\rm =4.18\times (100+100)\times (28.4-25.0){=2842}{.4\;\rm J=2}{.8424\;\rm kJ}$,中和反应的反应热$\Delta H=-\dfrac{ {Q}}{ {n(}{{\text{H}}_{\text{2}}}\text{O)}}=-\dfrac{2.8424\;\rm \text{kJ}}{0.05\;\rm \text{mol}}=-56.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
若分多次将$\rm NaOH$溶液倒入内筒中,则测得中和热$\Delta H$的绝对值将 $\rm ($将合适的选项字母填入横线,下同$\rm )$;若用$100\ \text{mL }0.50\ \text{mol}\cdot {{\text{L}}^{-1}}\text{ C}{{\text{H}}_{3}}\text{COOH}$溶液代替盐酸进行实验,测得反应前后温度的变化值 ;若配制$\rm NaOH$溶液时俯视容量瓶的刻度线,则测得中和热$\Delta H$的绝对值将 。
$\rm A$.偏大 $\rm B$.偏小 $\rm C$.不变 $\rm D$.无法判断
$\\rm B$;$\\rm B$;$\\rm A$
"]]若分多次将$\rm NaOH$溶液倒入内筒中,部分能量损耗,放出的热量减小,则测得中和热$\Delta H$的绝对值将偏小,故选:$\rm B$;若用$100\ \text{mL }0.50\ \text{mol}\cdot {{\text{L}}^{-1}}\text{ C}{{\text{H}}_{3}}\text{COOH}$溶液代替盐酸进行实验,醋酸电离吸收热量,反应放热偏少,测得反应前后温度的变化值偏小,故选:$\rm B$;配制$\rm NaOH$溶液时,俯视容量瓶刻度线,导致配制$\rm NaOH$溶液体积偏小,$\rm NaOH$浓度偏大,中和氢氧化钠消耗盐酸体积偏小,生成水的物质的量减小,则测得中和热的绝对值将偏大,故选:$\rm A$;
下列说法正确的是$(\quad\ \ \ \ )$
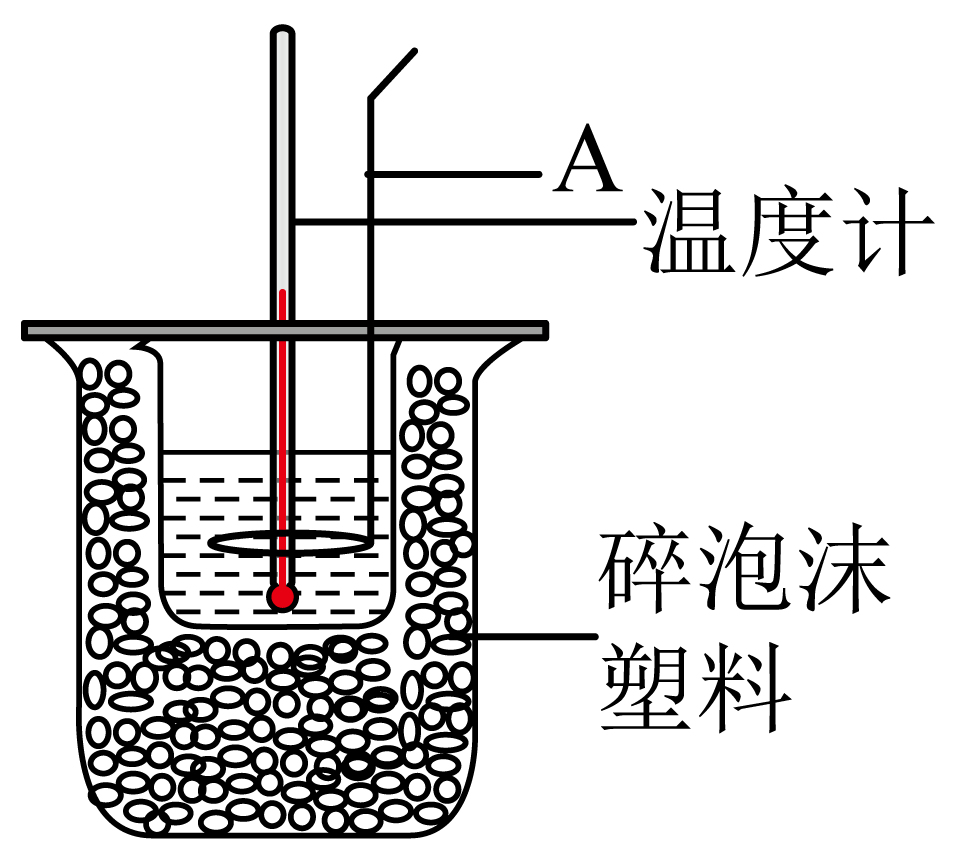
仪器$\\rm A$是金属搅拌棒
","稍过量的氢氧化钠是确保盐酸完全反应
","测量过盐酸的温度计立即测$\\text{NaOH}$溶液的温度
","用氢氧化钡和硫酸代替氢氧化钠溶液和盐酸,结果也是正确的
"]$\rm A$.金属搅拌棒具有导热性,会造成热量散失,仪器$\rm A$不能是金属搅拌棒,故$\rm A$错误;
$\rm B$.稍过量的氢氧化钠是确保盐酸完全反应,故$\rm B$正确;
$\rm C$.酸碱混合时,为了防止热量散失,$\rm NaOH$溶液应迅速倒入小烧杯中,不断搅拌,故$\rm C$错误;
$\rm D$.氢氧化钡和硫酸反应生成硫酸钡沉淀,若用氢氧化钡和硫酸用代替氢氧化钠和盐酸溶液,结果不同,故$\rm D$错误。
高中 | 离子方程式题目答案及解析(完整版)
