高中 | 化学键 题目答案及解析
稿件来源:高途
高中 | 化学键题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
化学键
一种从废旧芯片$\rm ($主要成分为单晶硅,还含有塑料和少量$\rm Au$、$\rm Ag$、$\rm Cu$、$\rm Pd$等金属,除$\rm Au$外其他金属均可溶于浓硝酸$\rm )$中回收和利用贵金属的流程如下。
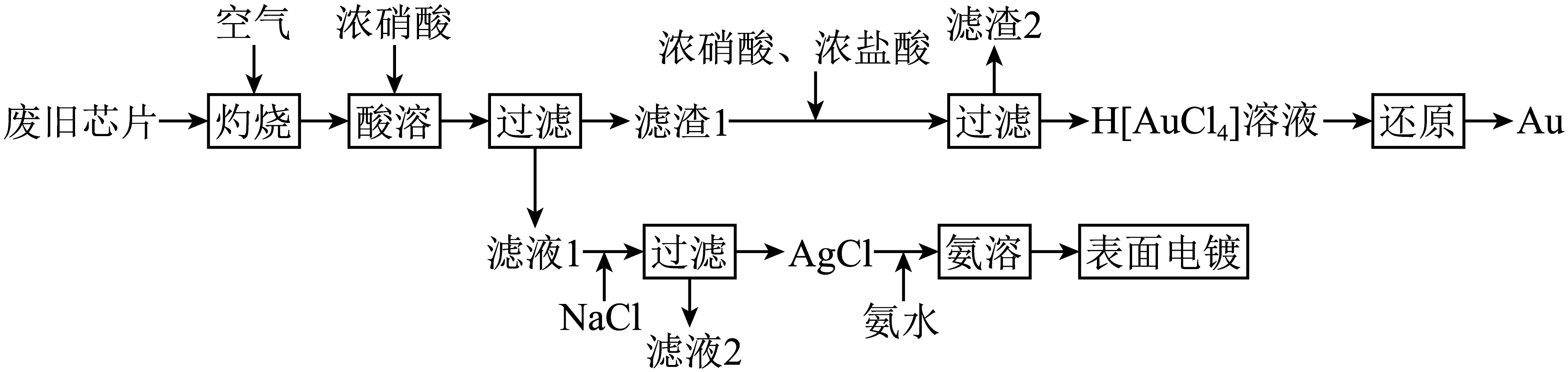
已知:$\rm Si$在空气中加热不反应;$\rm Au$被$\rm HN{{O}_{3}}$氧化成$\rm A{{u}^{3+}}$的反应平衡常数$K\lt {{10}^{-5}}$;$\rm A{{u}^{3+}}$可与$\rm C{{l}^{-}}$发生反应:$\rm A{{u}^{3+}}+4C{{l}^{-}}={{[AuC{{l}_{4}}]}^{-}}$;$\rm H[AuC{{l}_{4}}]$在水溶液中完全电离。
回答下列问题:
从产物的分离提纯和绿色化学的角度考虑,“灼烧”的目的是 。
去除塑料;减少酸溶过程中氮氧化物的生成
"]]通入空气“灼烧”的目的是除去塑料,同时将$\rm Cu$、$\rm Ag$等金属部分氧化为对应的氧化物,使得“酸溶”过程中氮氧化物的生成量减小,减少对环境的污染。
浓硝酸与浓盐酸的比例为$\rm 1:3$时溶解$\rm Au$的效果较好,此时$\rm HN{{O}_{3}}$被还原为$\rm NO$。写出$\rm Au$溶解过程中发生反应的离子方程式: 。
$\\rm Au+NO_{3}^{-}+4H^{+}+4Cl^{-}={{[AuC{{l}_{4}}]}^{-}}+NO\\uparrow +2H_{2}O$
"]]由已知信息可知,浓硝酸与浓盐酸的比例为$\rm 1:3$时溶解$\rm Au$的效果较好,此时$\rm HN{{O}_{3}}$被还原为$\rm NO$,$\rm Au$被氧化为$\rm {{[AuC{{l}_{4}}]}^{-}}$,根据得失电子守恒和电荷守恒配平离子方程式为:$\rm Au+NO_{3}^{-}+4H^{+}+4Cl^{-}={{[AuC{{l}_{4}}]}^{-}}+NO\uparrow +2H_{2}O$。
“滤渣$\rm 2$”的主要成分是 $\rm ($填化学式$\rm )$。
$\\rm Si$
"]]废旧芯片中含有的物质中除$\rm Si$与$\rm Au$以外都被灼烧或溶于硝酸中,$\rm Au$溶于浓硝酸与浓盐酸的混合物中,因此剩余不溶的“滤渣$\rm 2$”为$\rm Si$。
“滤液$\rm 2$”中含有$\rm Cu$、$\rm Pd$等金属元素,可进一步将其分离提纯。
①基态$\rm Cu$的价层电子排布式为 。
②溶液中的$\rm P{{d}^{2+}}$经过一定处理后可以得到四配位的$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$沉淀,其有$\rm 2$种同分异构体$\rm a$和$\rm b$。下列说法正确的有 $\rm ($填标号$\rm )$。
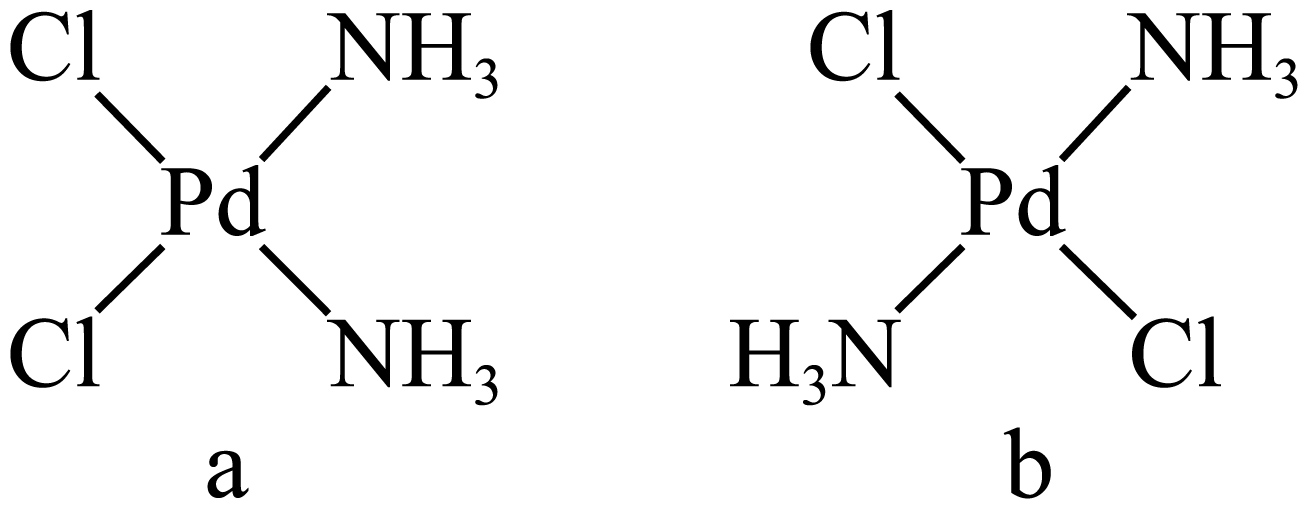
$\rm A$.$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$中存在的化学键类型是配位键、离子键
$\rm B$.$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$的晶体类型属于分子晶体
$\rm C$.$\rm a$和$\rm b$的空间结构均为四面体形
$\rm D$.$\rm a$的极性大于$\rm b$
③某研究小组以$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$为原料制备金属$\rm Pd$。将$\rm 21.1\ g\ Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$配制成悬浊液,向其中加入足量盐酸后,用氨水调节$\rm pH$至弱碱性,得到$\rm [Pd{{(N{{H}_{3}})}_{4}}]C{{l}_{2}}$溶液。然后加入$\rm 50.00\ mL\ 8.0\ mol/L$的水合肼$\rm ({{N}_{2}}{{H}_{4}}\cdot {{H}_{2}}O)$溶液还原,得到$\rm Pd$的同时生成无色、无味、无毒的气体。假定二价$\rm Pd$被完全还原,则产生的气体在标准状况下的体积为 。
$\\rm 3d^{10}4s^{1}$;$\\rm BD$;$\\rm 1.12\\ L$
"]]$\rm (4)$①$\rm Cu$在元素周期表中的位置为第四周期第Ⅰ$\rm B$族,其价层电子排布式为$\rm 3d^{10}4s^{1}$。
②$\rm A$.$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$为四配位,两个$\rm Cl^{-}$和两个$\rm NH_{3}$分子均以配位键与$\rm Pd$相连,无离子键,$\rm A$错误。
$\rm B$.$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$为分子化合物,无离子键,属于分子晶体,$\rm B$正确。
$\rm C$.如果$\rm Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$的空间结构为四面体形,则不会存在两种同分异构体,$\rm C$错误。
$\rm D$.$\rm a$和$\rm b$相比,$\rm b$的对称性更好,故$\rm a$的极性更大,$\rm D$正确。
③$\rm 21.1\ g\ Pd{{(N{{H}_{3}})}_{2}}C{{l}_{2}}$溶液加入$\rm 50.00\ mL\ 8.0\ mol/L$的水合肼$\rm ({{N}_{2}}{{H}_{4}}\cdot {{H}_{2}}O)$溶液还原,得到$\rm Pd$的同时生成无色、无味、无毒的气体为$\rm N_{2}$,该反应中$\rm N$元素由$\rm -2$价上升到$\rm 0$价,$\rm Pd$元素由$\rm +2$价下降到$\rm 0$价,根据得失电子守恒,该反应转移$\rm \dfrac{21.1\ g}{211\ g/mol}\times 2=0.2\ mol$电子,则生成$n{\rm (N_{2})}=\rm \dfrac{0.2\ mol}{4}=0.05\ mol$,标准状况下的体积为$\rm 0.05\ mol\times 22.4\ L/mol=1.12\ L$。
$\rm AgCl$沉淀用氨水溶解后可直接用于表面电镀,将待镀元件制成电极放置于“氨溶”后所得溶液中通电即可进行电镀,阴极上发生的电极反应为 。
$\\rm {{[ Ag(N{{H}_{3}}{{)}_{2}} ] }^{+}}+{{e}^{-}}=Ag+2N{{H}_{3}}\\uparrow $
"]]“氨溶”过程中发生的反应为$\rm AgCl+2N{{H}_{3}}= [ Ag(N{{H}_{3}}{{)}_{2}}{{ ] }^{+}}+C{{l}^{-}}$,所得溶液中存在$\rm {{ [ Ag(N{{H}_{3}}{{)}_{2}} ]}^{+}}$,阴极$\rm {{[ Ag(N{{H}_{3}}{{)}_{2}} ] }^{+}}$发生还原反应生成$\rm Ag$,根据得失电子守恒和电荷守恒配平电极反应式为$\rm {{ [ Ag(N{{H}_{3}}{{)}_{2}} ] }^{+}}+{{e}^{-}}=Ag+2N{{H}_{3}}\uparrow $。
高中 | 化学键题目答案及解析(完整版)
