高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物$({\rm N}{{\rm O}_{x}})$和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。

$\rm {{(N{{H}_{4}})}_{2}}S{{O}_{4}}$溶液中的离子浓度由大到小顺序是 。
$c{\\rm (NH_{4}^{+})}{\\gt }c{\\rm (SO_{4}^{2-})}{\\gt }c({{\\rm H}^{+}}){\\gt }c\\rm (O{{H}^{-}})$
"]]$\rm {{(N{{H}_{4}})}_{2}}S{{O}_{4}}$溶液中铵根离子水解使溶液显酸性,$c{\rm (NH_{4}^{+})}{{\gt }{c}}({{\rm H}^{+}}){{\gt }{c}}\rm (O{{H}^{-}})$,由于$\rm NH_{4}^{+}$水解微弱,且根据$\rm {{(N{{H}_{4}})}_{2}}S{{O}_{4}}$的化学式可知离子浓度大小为$c{\rm (NH_{4}^{+})}{\gt }c{\rm (SO_{4}^{2-})}{\gt }c({{\rm H}^{+}}){\gt }c\rm (O{{H}^{-}})$。
①已知:$\rm S{{O}_{2}}$生成$\rm S{{O}_{3}}$总反应的化学方程式是${\rm 2S{{O}_{2}}(g)+{{O}_{2}}(g)\rightleftharpoons 2S{{O}_{3}}(g)}\quad\Delta H=-196.6\rm \ kJ\cdot mo{{l}^{-1}}$,此反应可通过如下两步完成:${\rm 2 {NO}({g})+O_{2}({g}) \rightleftharpoons 2 {NO}_{2}({g})}\quad\Delta {{H}_{1}}=-113\rm \ kJ\cdot mo{{l}^{-1}}$;${\rm N{{O}_{2}}(g)+S{{O}_{2}}(g)\rightleftharpoons S{{O}_{3}}(g)+NO(g) }\quad\Delta{{H}_{2}}$。则$\Delta {{H}_{2}}=$ 。
②一定温度下,向$\rm 2\ L$恒容密闭容器中充入$\rm N{{O}_{2}}$和$\rm S{{O}_{2}}$各$\rm 1\ mol$,$\rm 5\ min$达到平衡,此时容器中$\rm N{{O}_{2}}$和$\rm NO$的浓度之比为$\rm 1:3$,则$\rm N{{O}_{2}}$的平衡转化率是 。
$\\rm -41.8\\ kJ\\cdot mo{{l}^{-1}}$;$\\rm 75\\%$
"]]①Ⅰ.${\rm 2S{{O}_{2}}(g)+{{O}_{2}}(g)\rightleftharpoons 2S{{O}_{3}}(g)}\quad \Delta H=-196.6\rm \ kJ\cdot mo{{l}^{-1}}$;Ⅱ.${\rm 2NO(g)+{{O}_{2}}(g)\rightleftharpoons 2N{{O}_{2}}(g) }\quad\Delta{{H}_{1}}=-113\rm \ kJ\cdot mo{{l}^{-1}}$,根据盖斯定律,$\rm ($Ⅰ$\rm -$Ⅱ$\rm )\times \dfrac{1}{2}$得到${\rm N{{O}_{2}}(g)+S{{O}_{2}}(g)\rightleftharpoons S{{O}_{3}}(g)+NO(g)}\quad\Delta {{H}_{2}}=\dfrac{-196.6-(-113)}{2}\ \rm kJ\cdot mo{{l}^{-1}}=-41.8\ kJ\cdot mo{{l}^{-1}}$。
②一定温度下,向$\rm 2\ L$恒容密闭容器中充入$\rm N{{O}_{2}}$和$\rm S{{O}_{2}}$各$\rm 1\ mol$,$\rm 5\ min$达到平衡,此时容器中$\rm N{{O}_{2}}$和$\rm NO$的浓度之比为$\rm 1:3$,设消耗$\rm N{{O}_{2}}$的物质的量为$x\ \rm mol$,列“三段式”:$\rm \begin{matrix} {} & \rm N{{O}_{2}}(g) & + & \rm S{{O}_{2}}(g) \\ 起始\rm (mol) & 1 & {} & 1 \\ 转化\rm (mol) & x & {} & x \\ 平衡\rm (mol) & 1-x & {} & 1-x \\ \end{matrix}\begin{matrix} \rightleftharpoons & \rm S{{O}_{3}}(g) & + & \rm NO(g) \\ {} & 0 & {} & 0 \\ {} & x & {} & x \\ {} & x & {} & x \\ \end{matrix}$,由于$\rm N{{O}_{2}}$和$\rm NO$的浓度之比为$\rm 1:3$,反应容器的容积不变,所以$n{\rm (N{{O}_{2}})}:n{\rm (NO)}=1:3$,$(1-x):x=1:3$,解得$x=0.75$,则$\rm N{{O}_{2}}$的平衡转化率$\rm =\dfrac{0.75\ mol}{1\ mol}\times 100\%=75\%$。
$\rm S{{O}_{2}}$属于酸性氧化物,将其通入$\rm NaOH$溶液中,得到$\rm NaHS{{O}_{3}}$溶液。
①$\rm NaHS{{O}_{3}}$溶液呈酸性,其原因是 。
②向$\rm pH=5$的$\rm NaHS{{O}_{3}}$溶液中滴加一定浓度的$\rm CaC{{l}_{2}}$溶液,溶液中出现浑浊,$\rm pH$降为$\rm 2$,用化学平衡移动原理解释溶液$\rm pH$降低的原因: 。
$\\rm HSO_{3}^{-}$在溶液中存在电离平衡:$\\rm HSO_{3}^{-}=SO_{3}^{2-}+{{H}^{+}}$,存在水解平衡:$\\rm HSO_{3}^{-}+{{H}_{2}}O\\rightleftharpoons {{H}_{2}}S{{O}_{3}}+O{{H}^{-}}$;$\\rm HSO_{3}^{-}$的电离程度大于其水解程度,所以溶液呈酸性;$\\rm HSO_{3}^{-}$在溶液中存在电离平衡:$\\rm HSO_{3}^{-}\\rightleftharpoons SO_{3}^{2-}+{{H}^{+}}$,加入$\\rm CaC{{l}_{2}}$溶液后,$\\rm C{{a}^{2+}}+SO_{3}^{2-}=CaS{{O}_{3}}\\downarrow $,$c{\\rm (SO_{3}^{2-})}$减小,使$\\rm HSO_{3}^{-}$的电离平衡右移,$c\\rm \\left({H}^{+}\\right)$增大,$\\rm pH$降低
"]]①$\rm NaHS{{O}_{3}}$溶液呈酸性,其原因是$\rm HSO_{3}^{-}$在溶液中存在电离平衡:$\rm HSO_{3}^{-}=SO_{3}^{2-}+{{H}^{+}}$,还存在水解平衡:$\rm HSO_{3}^{-}+{{H}_{2}}O\rightleftharpoons {{H}_{2}}S{{O}_{3}}+O{{H}^{-}}$,由于$\rm HSO_{3}^{-}$的电离程度大于其水解程度,所以$\rm NaHS{{O}_{3}}$溶液呈酸性。
②$\rm NaHS{{O}_{3}}$溶液中加入$\rm CaC{{l}_{2}}$溶液后反生反应:$\rm C{{a}^{2+}}+SO_{3}^{2-}=CaS{{O}_{3}}\downarrow $,$c{\rm (SO_{3}^{2-})}$减小,使$\rm HSO_{3}^{-}$的电离平衡右移,$c\rm \left({H}^{+}\right)$增大。
通过$\rm NO$,传感器可监测${\rm N}{{\rm O}_{x}}$的含量,其工作原理示意图如下。
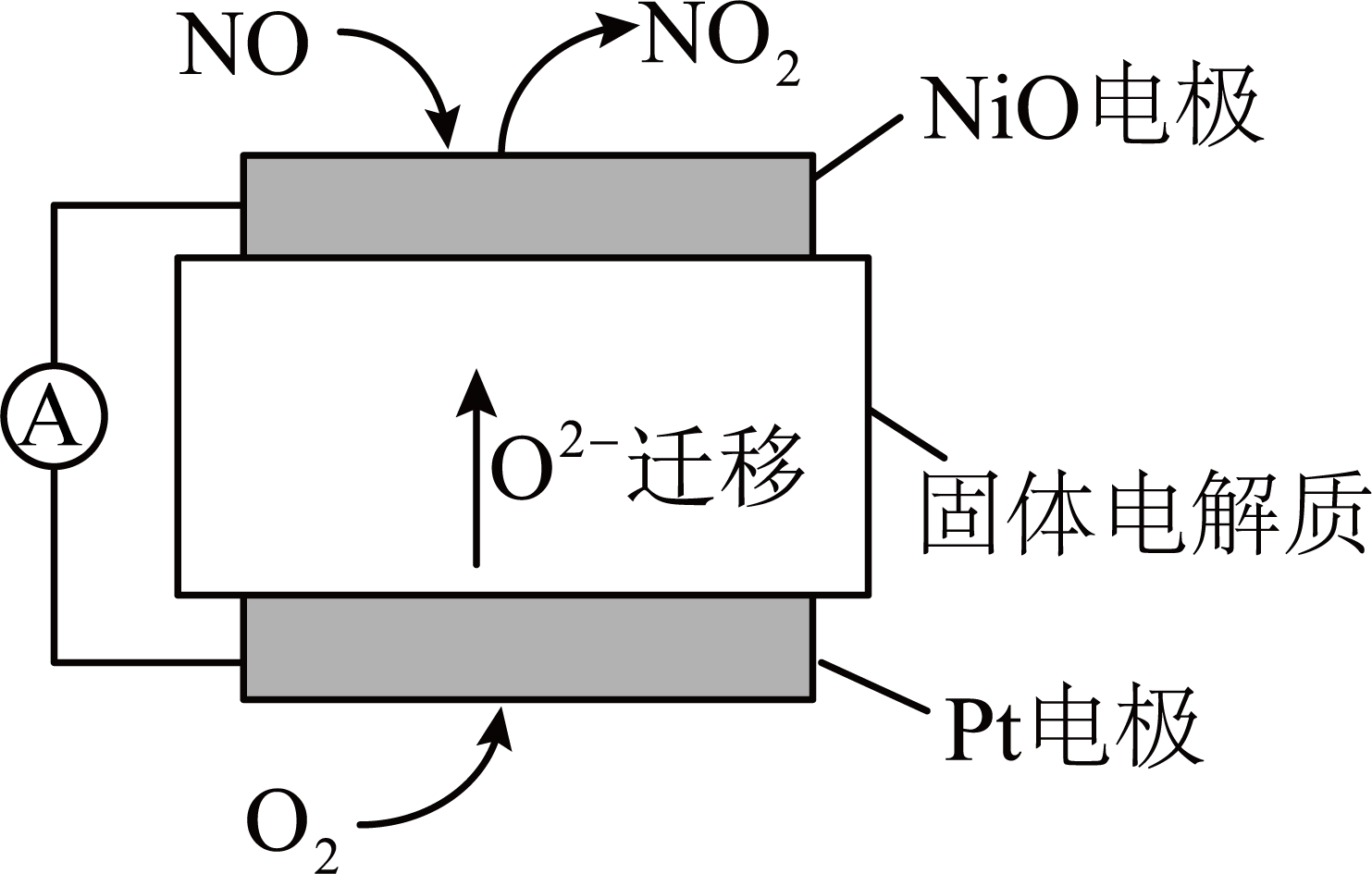
①$\rm NiO$电极上发生的是 $\rm ($填“氧化”或“还原”$\rm )$反应。
②写出$\rm Pt$电极的电极反应式: 。
氧化;$\\rm {{O}_{2}}+4{{e}^{-}}=2{{O}^{2-}}$
"]]①$\rm NiO$电极为负极,在负极上$\rm NO$失去电子,发生氧化反应。
②$\rm {{O}_{2}}$在$\rm Pt$电极上得电子变为$\rm {{O}^{2-}}$,发生还原反应,所以$\rm Pt$电极的电极反应式为$\rm {{O}_{2}}+4{{e}^{-}}=2{{O}^{2-}}$。
高中 | 盖斯定律题目答案及解析(完整版)
