高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
我国含硫天然气占总开采量$\rm 70\%$左右,其中含有的硫化氢毒性大、腐蚀性强,对天然气开采、运输、使用等环节有严重影响。甲烷硫化氢重整制氢是利用含硫天然气的一条极具潜力的途径,该反应为:$\rm CH_{4}(g)+2H_{2}S(g)⇌CS_{2}(g)+4H_{2}(g)$ 。
已知${\rm 2H_{2}S(g)+CO_{2}(g)⇌CS_{2}(g)+2H_{2}O(l)}\quad\Delta H=+30\rm \ kJ/mol$,结合下表中甲烷和氢气的燃烧热数值,计算甲烷硫化氢重整制氢反应的$\Delta H=$ 。
| 物质 | $\rm CH_{4}$ | $\rm H_{2}$ |
| 燃烧热($\Delta H$)$\rm /kJ/mol$ | $\rm -890$ | $\rm -280$ |
$\\rm +260\\ kJ/mol$
"]]根据甲烷和氢气的燃烧热数值可得热化学方程式①、②:
① ${\rm C{{H}_{4}}(g)+2{{O}_{2}}(g)=C{{O}_{2}}(g)+2{{H}_{2}}O(l)}\quad\Delta H=-890\rm \ kJ\cdot mo{{l}^{-1}}$;
② ${\rm 2{{H}_{2}}(g)+{{O}_{2}}(g)=2{{H}_{2}}O(l)}\quad\Delta H=-560\rm \ kJ\cdot mo{{l}^{-1}}$;
已知反应:③ ${\rm 2H_{2}S(g)+CO_{2}(g)\rightleftharpoons CS_{2}(g)+2H_{2}O(l)}\quad\Delta H=+30\rm \ kJ\cdot mo{{l}^{-1}}$;
根据盖斯定律,由① $\rm +$③ $\rm -$② $\rm \times 2$得${\rm CH_{4}(g)+2H_{2}S(g)\rightleftharpoons CS_{2}(g)+4H_{2}(g)}\quad\Delta H=(-890\rm \ kJ\cdot mo{{l}^{-1}})+(+30\ kJ\cdot mo{{l}^{-1}})-(-560\ kJ\cdot mo{{l}^{-1}})\times 2=+260\ kJ\cdot mo{{l}^{-1}}$。
恒压条件下,$\rm CH_{4}$与$\rm H_{2}S$按物质的量比$\rm 1:3$通入反应器,测定$\rm CH_{4}$平衡转化率随温度的变化情况,绘制曲线$\rm M$(见下图)。保持进料口总压、$\rm CH_{4}$与$\rm H_{2}S$物质的量比恒定,通入一定量的$\rm He$作辅气,则曲线应变为 (填“曲线$\rm P$”或“曲线$\rm Q$”),理由是 。
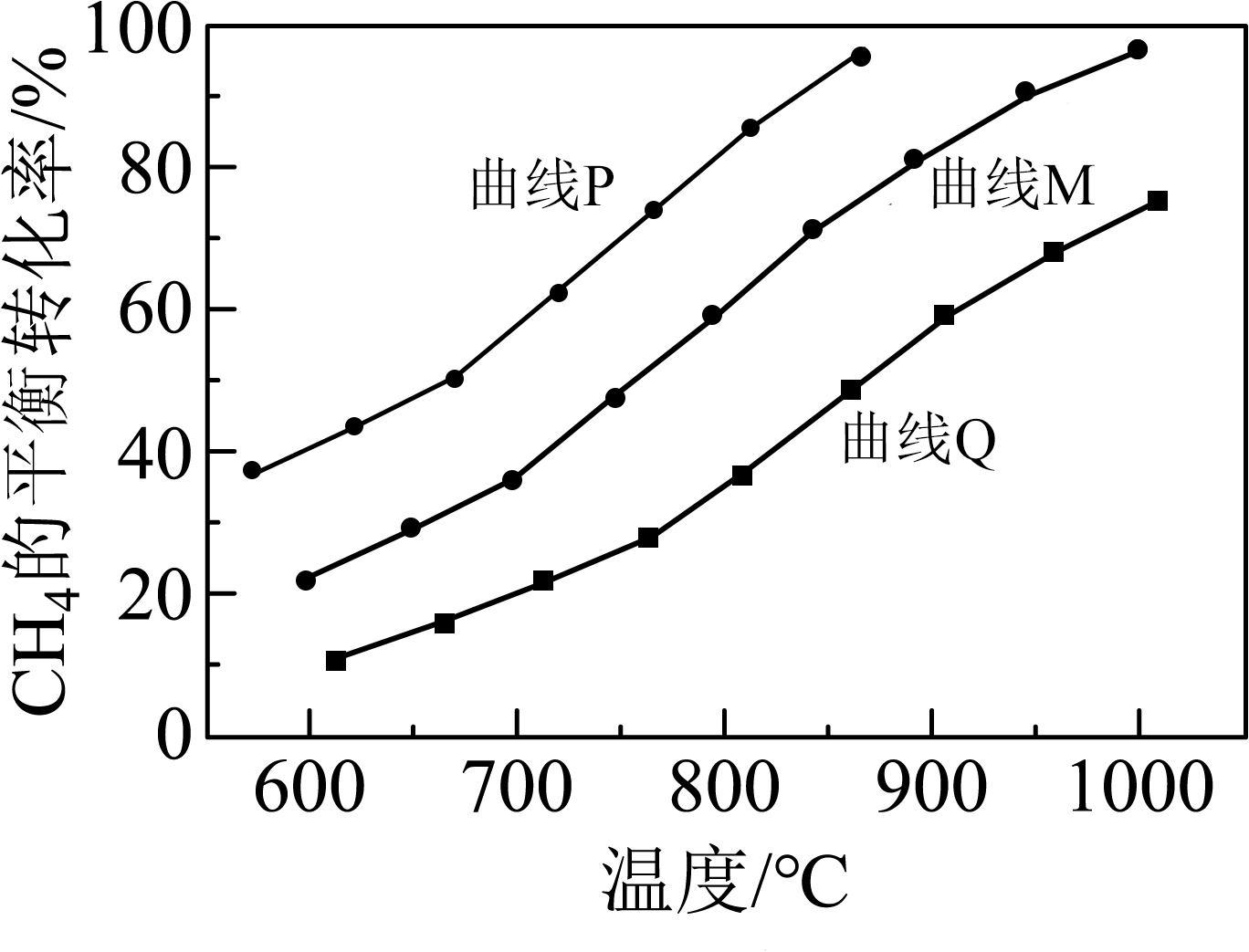
曲线$\\rm P$; 该反应为气体系数和减小的反应,总压一定时,充入$\\rm He$反应物分压减小,平衡向正向移动,相同温度下$\\rm CH_{4}$平衡转化率增大
"]]恒压条件下,$\rm CH_{4}$与$\rm H_{2}S$按物质的量比$\rm 1:3$通入反应器,测定$\rm CH_{4}$平衡转化率随温度的变化情况为曲线$\rm M$所示。保持进料口总压、$\rm CH_{4}$与$\rm H_{2}S$物质的量比恒定,通入一定量的$\rm He$作辅气,由于该反应$\rm CH_{4}(g)+2H_{2}S(g)\rightleftharpoons CS_{2}(g)+4H_{2}(g)$ 为气体系数和增大的反应,总压一定时,充入$\rm He$反应物分压减小,化学平衡正向移动,相同温度下$\rm CH_{4}$平衡转化率增大,则曲线应变为曲线$\rm P$;
假设在恒温$\rm 2\ L$刚性容器中,通入$\rm 4\ mol$ $\rm CH_{4}$、$\rm 4\ mol$ $\rm H_{2}S$和$\rm 2\ mol\ He$作辅气,起始总压为$P_{0}$ $\rm MPa$,$\rm CH_{4}$和$\rm H_{2}S$的转化率与时间的关系如下图。

①用分压的变化表示$\rm 0\sim 5\ min$内$\rm H_{2}$的平均反应速率为 $\rm MPa/min$(分压![]() 总压$\rm \times $该气体物质的量分数)。
总压$\rm \times $该气体物质的量分数)。
②可作为该反应达平衡的标志是 (填选项)。
$\rm a$.$\rm CH_{4}$的消耗速率与$\rm CS_{2}$的生成速率之比为$\rm 1:1$
$\rm b$.$\rm CH_{4}$的体积分数不再变化
$\rm c$.$\dfrac{c{\rm (C{{H}_{4}})}}{c{\rm ({{H}_{2}}S)}}$不再变化
$\rm d$.混合气体的密度不再改变
③该温度下,反应$\rm CH_{4}(g)+2H_{2}S(g)⇌CS_{2}(g)+4H_{2}(g)$ 的$ K_{x}=$ 。$(K_{x}$为物质的量分数平衡常数,用平衡物质的量分数代替平衡浓度计算$\rm )$
$0.032P_{0}$ ;$\\rm bc$ ;$\\rm \\dfrac{4}{27}$或$\\rm 0.15$
"]]①由图可知,$\rm 0\sim 5\ min$内消耗的$\rm H_{2}S$为$\rm 4\ mol\times 20\%=0.8\ mol$。
$\rm \begin{matrix} {} & \rm C{{H}_{4}}(g) & + & \rm 2{{H}_{2}}S(g) & \rightleftharpoons & \rm C{{S}_{2}}(g) & + & \rm 4{{H}_{2}}(g) \\ 初始\rm mol & 4 & {} & 4 & {} & 0 & {} & 0 \\ 变化\rm mol & 0.4 & {} & 0.8 & {} & 0.4 & {} & 1.6 \\ \rm 5\ min \ mol & 3.6 & {} & 3.2 & {} & 0.4 & {} & 1.6 \\ \end{matrix}$
则$\rm 5\ min$时气体的总物质的量为:$\rm 3.6\ mol+3.2\ mol+0.4\ mol+1.6\ mol+2\ mol=10.8\ mol$,反应后的总压为$\dfrac{10.8}{10}{{P}_{0}}$。用分压的变化表示$\rm 0\sim 5\ min$内$\rm H_{2}$的平均反应速率 $=\dfrac{\dfrac{1.6}{10.8}\times \dfrac{10.8}{10}{{P}_{0}}}{5}\ {\rm MPa/min}=0.032P_{0}$ $\rm MPa/min$;
②$\rm a$.$\rm CH_{4}$的消耗速率与$\rm CS_{2}$的生成速率方向相同,$\rm CH_{4}$的消耗速率与$\rm CS_{2}$的生成速率之比为$\rm 1:1$不能说明正逆反应速率相等,不能证明反应达到化学平衡状态,$\rm a$不符合题意;
$\rm b$.$\rm CH_{4}$的体积分数不再变化,说明$\rm CH_{4}$的生成速率与消耗速率相等,正逆反应速率相等,能证明反应达到化学平衡状态,$\rm b$符合题意;
$\rm c$.刚开始加入的$c{\rm (C{{H}_{4}})}$和$c{\rm ({{H}_{2}}S)}$相等,但甲烷和硫化氢在反应中消耗的速率不同,如果$\dfrac{c{\rm (C{{H}_{4}})}}{c{\rm ({{H}_{2}}S)}}$不再变化,说明二者浓度不再发生变化,证明反应达到化学平衡状态,$\rm c$符合题意;
$\rm d$.该反应中反应物和生成物均为气体,无论反应是否达到化学平衡状态,混合气体的密度均不会改变,$\rm d$不符合题意;
③由图可知,达到化学平衡状态时$\rm H_{2}S$转化率为$\rm 50\%$,消耗$\rm H_{2}S$为$\rm 4\ mol\times 50\%=2\ mol$。
$\rm \begin{matrix} {} &\rm C{{H}_{4}}(g) & + & \rm 2{{H}_{2}}S(g) & \rightleftharpoons & \rm C{{S}_{2}}(g) & + & \rm 4{{H}_{2}}(g) \\ 初始\rm mol & 4 & {} & 4 & {} & 0 & {} & 0 \\ 变化\rm mol & 1 & {} & 2 & {} & 1 & {} & 4 \\ 平衡\rm mol & 3 & {} & 2 & {} & 1 & {} & 4 \\ \end{matrix}$
则平衡时气体的总物质的量为:$\rm 3\ mol+2\ mol+1\ mol+4\ mol+2\ mol=12\ mol$,该温度下,反应$\rm CH_{4}(g)+2H_{2}S(g)\rightleftharpoons CS_{2}(g)+4H_{2}(g)$ 的$K_{x}=\dfrac{(\dfrac{4}{12}{{)}^{4}}\times \dfrac{1}{12}}{(\dfrac{2}{12}{{)}^{2}}\times \dfrac{3}{12}}=\dfrac{4}{27}≈0.15$。
阿伦尼乌斯公式表示了速率常数与温度、活化能的关系,公式为$k=A{{\rm e}^{-\dfrac{{{E}_{\rm a}}}{RT}}}$,其中$k$为速率常数,$A$和$R$为常数,$R≈8.3\rm \ J/(mol\cdot K)$,$\rm e$为自然对数的底,$E_{\rm a}$为反应的活化能,$T$为开氏温度。已知在温度为$\rm 300\ K$时,甲烷硫化氢重整制氢使用$\rm Mo/Al_{2}O_{3}$催化剂活化能比原来降低$\rm 24.9\ kJ/mol$,则速率常数变为原来的 倍。
$\\rm {{e}^{10}}$
"]]根据阿伦尼乌斯公式为$k=A{{\rm e}^{-\dfrac{{{E}_{\rm a}}}{RT}}}$,其中$k$为速率常数,$A$和$R$为常数,$R≈8.3\rm \ J/(mol\cdot K)$,$\rm e$为自然对数的底,$E_{\rm a}$为反应的活化能,$T$为开氏温度。已知在温度为$300\ \rm K$时,甲烷硫化氢重整制氢使用$\rm Mo/Al_{2}O_{3}$催化剂活化能比原来降低$\rm 24.9\ kJ/mol$,设原速率常数为$k_{1}$,使用$\rm Mo/Al_{2}O_{3}$催化剂时的速率常数为$k_{2}$,$\dfrac{{{k}_{2}}}{{{k}_{1}}}=\dfrac{A{{\rm e}^{-\dfrac{{{E}_{\rm a}}-\Delta {{E}_{\rm a}}}{RT}}}}{A{{\rm e}^{-\dfrac{{{E}_{\rm a}}}{RT}}}}={{\rm e}^{\dfrac{\Delta {{E}_{\rm a}}}{RT}}}$,代入数据可得:$\dfrac{{{k}_{2}}}{{{k}_{1}}}={{\rm e}^{\dfrac{\Delta {{E}_{\rm a}}}{RT}}}={{\rm e}^{\dfrac{24.9\times {{103}}}{8.3\times 300}}}={{\rm e}^{10}}$。
已知$\rm Mo/Al_{2}O_{3}$催化剂表面的活性位点数量是决定该催化剂活性的重要因素,当原料中甲烷含量较高时会裂解产生积炭,导致催化剂活性降低,分析可能的原因是 。
积碳覆盖了催化剂的活性位点
"]]当原料中甲烷含量较高时会裂解产生积炭,积碳覆盖了催化剂的活性位点,使催化剂的催化效率减小,从而导致催化剂活性降低。
高中 | 盖斯定律题目答案及解析(完整版)
