高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲烷催化双重整$\rm (BRM)$制备合成气$\rm (CO$和${{\text{H}}_{2}}\rm )$包括了水蒸气重整$\rm (SRM)$和二氧化碳重整$\rm (DRM)$两个反应。在$P=100\;\rm \text{kPa}$下,向密闭容器中按$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( {{\text{H}}_{2}}\text{O} \right):n\left( \text{C}{{\text{O}}_{2}} \right)=3:2:1$通入混合气,发生如下反应:
$\rm SRM$:$\text{C}{{\text{H}}_{4}}\left( \,\text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \,\text{g} \right)\qquad\Delta{{H}_{1}}$
$\rm DRM$:$\text{C}{{\text{H}}_{4}}\left( \,\text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \,\text{g} \right)\rightleftharpoons 2\text{CO}\left( \,\text{g} \right)+2{{\text{H}}_{2}}\left( \,\text{g} \right)\qquad\Delta{{H}_{2}}=+244.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
已知$\text{C}{{\text{O}}_{2}}\left( \,\text{g} \right)+{{\text{H}}_{2}}\left( \,\text{g} \right)=\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad \Delta{{H}_{3}}=+41.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,则$\Delta {{H}_{1}}=$ 。
$+203.1\\ \\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]根据盖斯定律求目标方程式的$\Delta {{ {H}}_{\text{1}}}$可得$\Delta {{H}_{1}}=\Delta {{H}_{2}}-\Delta {{H}_{3}}=\left( +244.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)-\left( +41.5\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)=+203.1\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
已知$\text{DRM}$反应$\Delta S=+257.34\ \text{J}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}}$,则下列所给温度能使该反应自发进行的是$(\quad\ \ \ \ )\rm ($填字母$\rm )$。
$100\\ \\text{K}$
","$900\\ \\text{K}$
","$1000\\ \\text{K}$
","$1200\\ \\text{K}$
"]根据$\Delta G=\Delta H-T\Delta S\lt 0$反应自发进行,将题中数据带入公式为$\left( +244.6 \right)-T\times \left( +257.34 \right)\times {{10}^{-3}}\lt 0$,计算可知$T\gt 950.5\text{ K}$;
重整体系中,各气体的转化率$ ({{ X}_{\text{i}}}\rm )$随温度的变化如图所示。
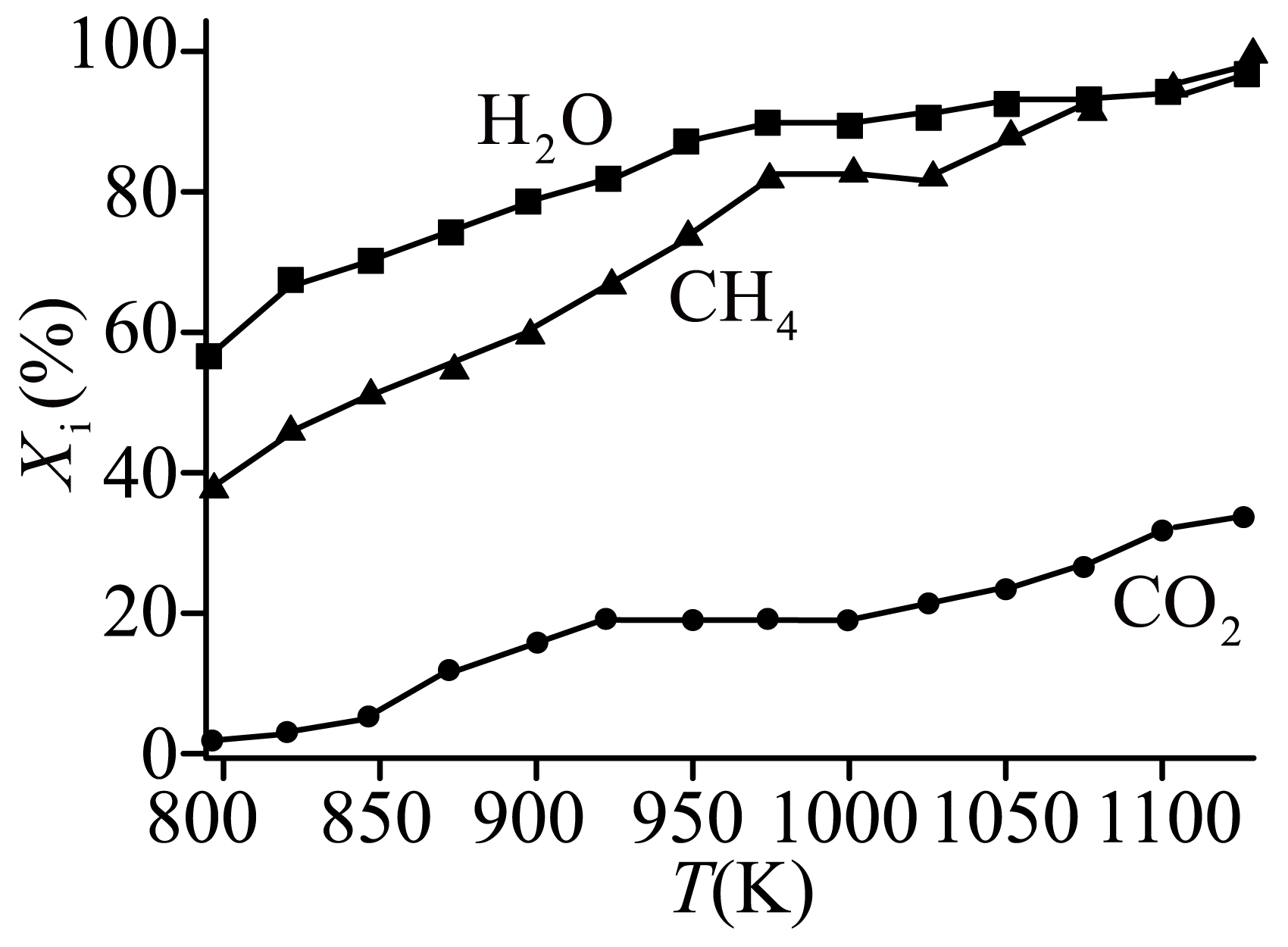
①$800\ \text{K}\sim 900\ \text{K}$时,$\text{C}{{\text{H}}_{4}}$和${{\text{H}}_{2}}\text{O}$的转化率之比一直约为$\rm 2: 3$,可能原因是 。
②解释在$950\ \text{K}\sim 1100\ \text{K}$,二氧化碳转化率一直增大的原因: 。
③在$1123\ \text{K}$、$100\;\rm \text{kPa}$条件下,若假设只发生$\text{SRM}$反应和$\text{DRM}$反应,平衡时${{X}_{\text{i}}}\left( {{\text{H}}_{2}}\text{O} \right)=90\%$,${{X}_{\text{i}}}\left( \text{C}{{\text{O}}_{2}} \right)=35\%$,则平衡时${{X}_{\text{i}}}\left( \text{C}{{\text{H}}_{4}} \right)=$ $\rm ($保留小数点后两位$\rm )$,${{P}_{\text{i}}}\left( {{\text{H}}_{2}} \right)=$ $\;\rm \text{kPa}$[保留小数点后一位,${{P}_{\text{i}}}$为分压$\rm ($已知:分压$=$总压$\times $物质的量的分数,$\text{R}$为气体的分压之比$\rm )]$。
$\\rm 800\\;K\\sim 900\\;K$时,主要发生$\\rm SRM$反应,投料比${n\\rm (CH_{4})}:n\\rm (H_{2}O)=3:2$,且$\\rm SRM$反应过程中的消耗量样,所以转化率之比一直约为$\\rm 2:3$;$\\rm DRM$反应开始发生,该反应为吸热反应,温度升高,平衡正向移动,二氧化碳转化率升高;$\\rm 71.67$;$\\rm 59.2$
"]]①根据题意,若向密闭容器中按$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( {{\text{H}}_{2}}\text{O} \right):n\left( \text{C}{{\text{O}}_{2}} \right)=3:2:1$通入混合气,由题图列出$\rm SRM$的三步法:
$\begin{matrix} {} & \text{C}{{\text{H}}_{4}}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right)\ & + & \text{3}{{\text{H}}_{2}}\left( \text{g} \right) \\起始 \text{/mol} & 3 & {} & 2 & {} & 0 & {} & 0 \\转变 \text{/mol} & x & {} & x & {} & x & {} & 3x \\平衡 \text{/mol} & 3-2x & {} & 2-2x & {} & x & {} & 3x \\ \end{matrix}$
根据$(2)$可知,$\rm DRM$反应需$ T\gt 950.5\;\rm K$时才自发,$\rm 800\;K\sim 900\;K$时,$\rm CH_{4}$和$\rm H_{2}O$的转化率之比一直约为$\rm 2:3$,可能原因是只发生$\rm SRM$反应,投料比$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( {{\text{H}}_{2}}\text{O} \right)=3:2$且$\rm SRM$反应过程中的消耗量一样,所以转化率之比一直约为$\rm 2:3$;
②$\rm 950\;K\sim 1100\;K$,此时$\rm DRM$反应开始发生,该反应为吸热反应,温度升高,平衡正向移动,二氧化碳转化率增大;
③根据题意,向密闭容器中按$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( {{\text{H}}_{2}}\text{O} \right):n\left( \text{C}{{\text{O}}_{2}} \right)=3:2:1$通入混合气,且$\rm H_{2}O$的转化率为$\rm 90\%$,$\rm CO_{2}$的转化率为$\rm 35\%$,列出$\rm SRM$、$\rm DRM$的三步法:
$\begin{matrix} {} & \text{C}{{\text{H}}_{4}}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right)\ & + & \text{3}{{\text{H}}_{2}}\left( \text{g} \right) \\ 起始\text{/mol} & 3 & {} & 2 & {} & 0 & {} & 0 \\ 转变\text{/mol} & 1.8 & {} & 1.8 & {} & 1.8 & {} & 5.4 \\ 平衡\text{/mol} & 0.85 & {} & 0.2 & {} & 2.5 & {} & 6.1 \\ \end{matrix}$
$\begin{matrix} {} & \text{C}{{\text{H}}_{4}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{2}}\left( \text{g} \right) & \rightleftharpoons & \text{2CO}\left( \text{g} \right)\ & + & \text{2}{{\text{H}}_{2}}\left( \text{g} \right) \\起始 \text{/mol} & 3 & {} & 2 & {} & 0 & {} & 0 \\ 转变\text{/mol} & 0.35 & {} & 0.35 & {} & 0.7 & {} & 0.7 \\平衡 \text{/mol} & 0.85 & {} & 0.2 & {} & 2.5 & {} & 6.1 \\ \end{matrix}$
所以${{X}_{\text{i}}}\left( \text{C}{{\text{H}}_{4}} \right)=\dfrac{2.15}{3}\times 100\%\approx 71.67\%$,${{P}_{\text{i}}}\left( {{\text{H}}_{2}} \right)=\dfrac{6.1}{10.3}\times 100\;\rm \text{kPa}\approx 59.2\;\rm \text{kPa}$。
甲烷催化双重整$\rm (BRM)$相较于单独的$\rm SRM$反应优点是 。
可以将二氧化碳转变为气体燃料,更有利于实现碳中和
"]]化学层面的“碳中和”主要指将二氧化碳重新生成对人类生产生活有用的含碳有机物,所以相较于单独的$\rm SRM$反应,甲烷催化双重整$\rm (BRM)$可以使二氧化碳转化为气体燃料,更有利于实现碳中和。
高中 | 化学平衡常数题目答案及解析(完整版)
