高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙烷脱氢转化是一类重要的乙烯定向生产技术,有望取代当前基于石油路线的蒸汽裂解工艺。回答下列问题:
已知$\rm C_{2}H_{6}$、$\rm C_{2}H_{4}$、$\rm H_{2}$的燃烧热$\Delta H$分别为$\rm -1559.8$ $\rm kJ·mol^{-1}$、$\rm -1411.0$ $\rm kJ·mol^{-1}$、$\rm -285.8$ $\rm kJ·mol^{-1}$,则下列反应${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)$的$\Delta H$为 。
$\\rm +137.0$ $\\rm kJ/mol$
"]]根据题意可知,①${{\text{C}}_{\text{2}}}{{\text{H}}_{6}}\left( \text{g} \right)+\dfrac{7}{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+3}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta H=-\text{1559}\text{.8}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$;
②${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\left( \text{g} \right)\text{+3}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta H=-\text{1411}\text{.0}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$;
③${{\text{H}}_{\text{2}}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta H=-\text{285}\text{.8}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$,则①$\rm -$②$\rm -$③得${{\text{C}}_{2}}{{\text{H}}_{6}}\left( \text{g} \right)={{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$,$\Delta H=\left( -1559.8+1411.0+285.8 \right)\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}=+137.0\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
乙烷的无氧脱氢反应${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)$是一个正向转化受限的反应过程,当引入一定量的氧气后,乙烯的收率显著提高,氧气的引入除了可能会阻止积炭的形成,还可能的原因是$\rm ($从化学平衡的角度写出两条$\rm )$ 。
引入氧气消耗氢气,同时氢气与氧气反应放热,温度升高,使平衡右移
"]]当引入一定量的氧气后,乙烯的收率显著提高,即平衡向右移动,化学平衡的角度的原因是:引入氧气消耗氢气,同时氢气与氧气反应放热,温度升高,使平衡右移;
二氧化碳辅助乙烷脱氢是一项二氧化碳资源利用的有效手段。实验室将$\rm 1$ $\rm mol$ $\rm C_{2}H_{6}$ 、$\rm 0.5$ $\rm mol$ $\rm CO_{2}$投入反应器,所得各平衡物料的量随温度变化曲线如图Ⅰ所示,在$\rm 500$ $\rm ^\circ\rm C$发生反应的化学方程式为 。实验室模拟“乙烷二氧化碳氧化脱氢反应”,在$T\text{ }{}^\circ \text{C}$、$\rm 5.1$ $\rm MPa$条件下,将$\rm 3.0$ $\rm mol$ $\rm C_{2}H_{6}$与$\rm 4.8$ $\rm mol$ $\rm CO_{2}$充入容积可变的恒温密闭容器,发生反应${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right)+\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)$,平衡时$p\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}} \right):p\left( \text{C}{{\text{O}}_{\text{2}}} \right)=1:4$,该反应的平衡常数${{K}_{\text{p}}}=$ $\rm MPa$。
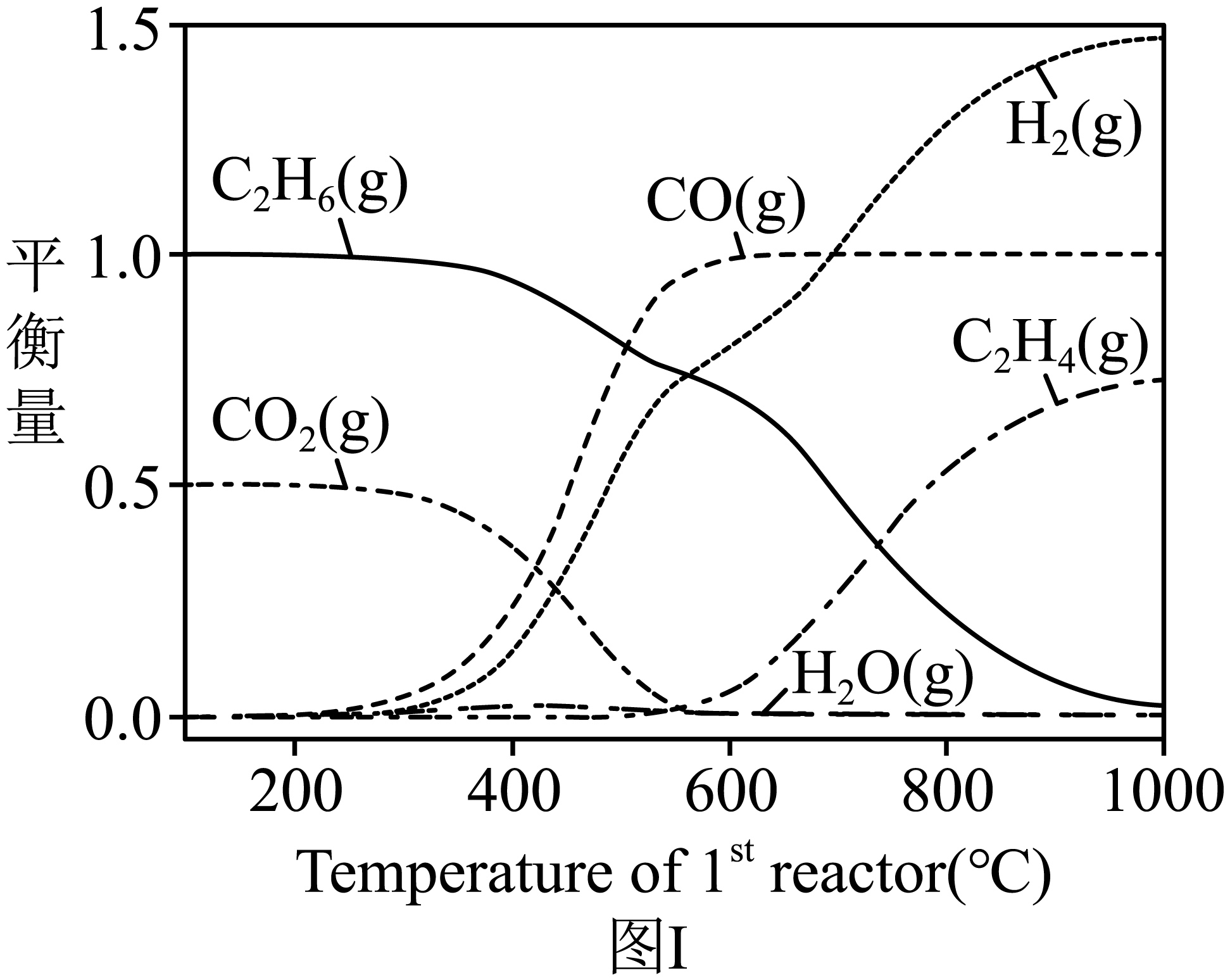
${{\\text{C}}_{2}}{{\\text{H}}_{6}}+2\\text{C}{{\\text{O}}_{2}}\\rightleftharpoons 4\\text{CO}+3{{\\text{H}}_{2}}$ ; $\\rm 4.8$
"]]如图可知,在$\rm 500$ $\rm ^\circ\rm C$时,还没有${{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)$生成,反应物是${{\text{C}}_{2}}{{\text{H}}_{6}}$、$\text{C}{{\text{O}}_{\text{2}}}$,生成物是$\text{CO}$、${{\text{H}}_{2}}$,化学方程式为${{\text{C}}_{2}}{{\text{H}}_{6}}+2\text{C}{{\text{O}}_{2}}\rightleftharpoons 4\text{CO}+3{{\text{H}}_{2}}$;
根据已知条件列三段式有$\begin{matrix} {} & {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & {{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{g} \right) & + & \text{CO}\left( \text{g} \right) \\ 初始 \text{mol} & 3 & {} & 4.8 & {} & 0 & {} & 0 & {} & 0 \\变化 \text{mol} & x & {} & x & {} & x & {} & x & {} & x \\平衡 \text{mol} & 3-x & {} & 4.8-x & {} & x & {} & x & {} & x \\ \end{matrix}$,$\dfrac{3-x}{x}=\dfrac{1}{4}$,解得$x=2.4\ \text{ mol}$,气体总物质的量为$\rm (0.6+2.4+2.4+2.4+2.4)$ $\rm mol=10.2$ $\rm mol$,$p\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)=p\left( {{\text{H}}_{2}}\text{O} \right)=p\left( \text{CO} \right)=p\left( \text{C}{{\text{O}}_{\text{2}}} \right)=\dfrac{2.4}{10.2}\times 5.1\text{ MPa}$,$p\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}} \right)=\dfrac{0.6}{10.2}\times 5.1\,\text{MPa}$,${{K}_{\text{p}}}=\dfrac{{{\left( \dfrac{2.4}{10.2}\times 5.1\text{ MPa} \right)}^{3}}}{\dfrac{2.4}{10.2}\times 5.1\text{ MPa}\times \dfrac{0.6}{10.2}\times 5.1\text{ MPa}}=4.8\text{ Mpa}$;
反应器中发生反应的$\Delta G$随温度变化曲线如图Ⅱ,关于反应${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{CHO}\left( \text{g} \right)$ 的叙述正确的是 $\rm ($填标号$\rm )$。
$\rm A$.$\Delta H\gt 0$,$\Delta S\gt 0$ $\rm B$.$\Delta H\lt 0$,$\Delta S\lt 0$
$\rm C$.$\Delta H\gt 0$,$\Delta S\lt 0$ $\rm D$.$\Delta H\lt 0$,$\Delta S\gt 0$
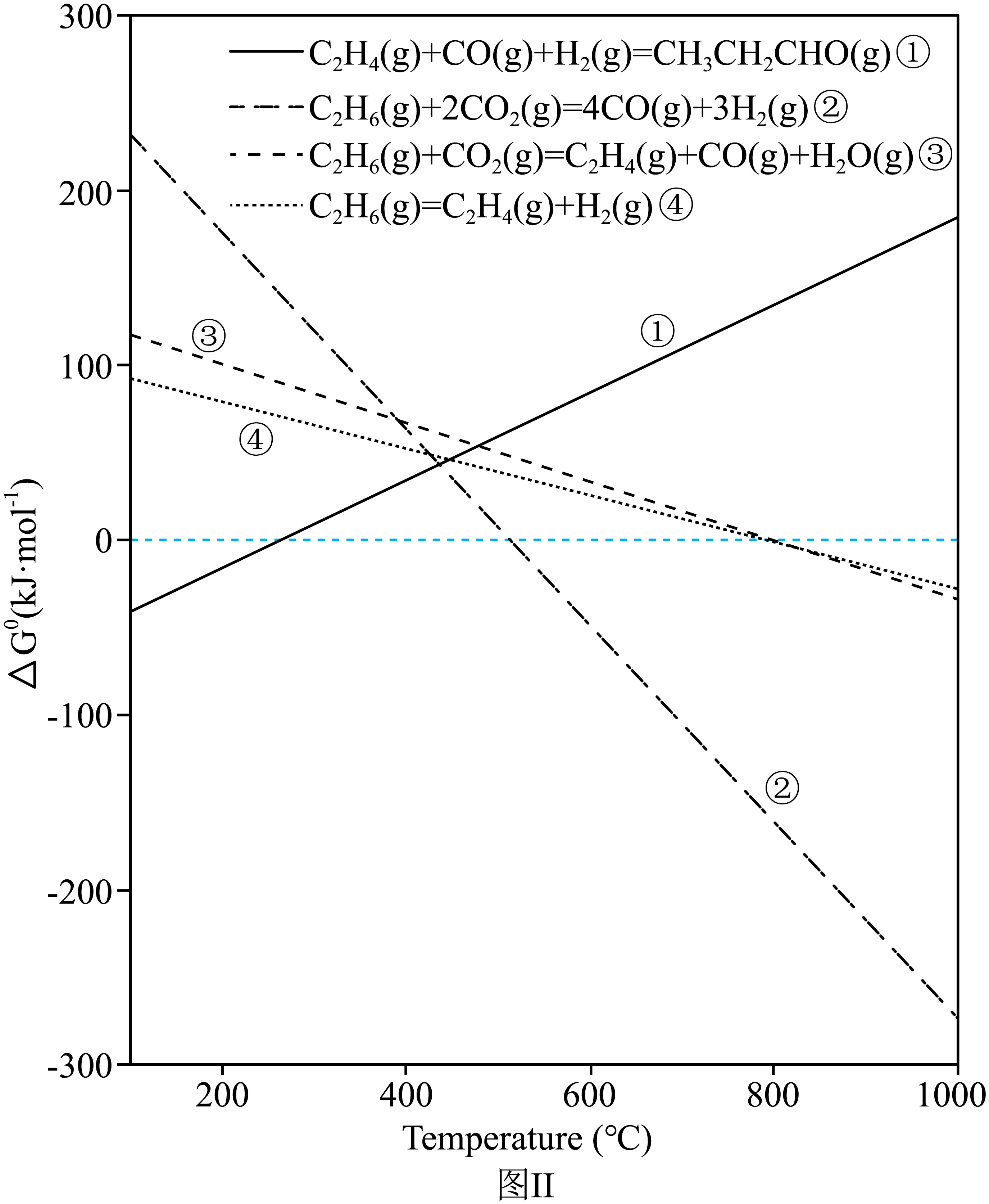
$\\rm B$
"]]由图可知,该反应低温下$\Delta G\lt 0$可自发进行,则依据$\Delta H-T\Delta S\lt 0$可知,$\Delta H\lt 0$、$\Delta S\lt 0$;
通过固体氧化物电化学$\rm (SOFC)$技术,实现了选择性乙烷电化学脱氢制乙烯,装置如图,$\rm b$极为 极,$\rm a$电极上发生的反应为 。
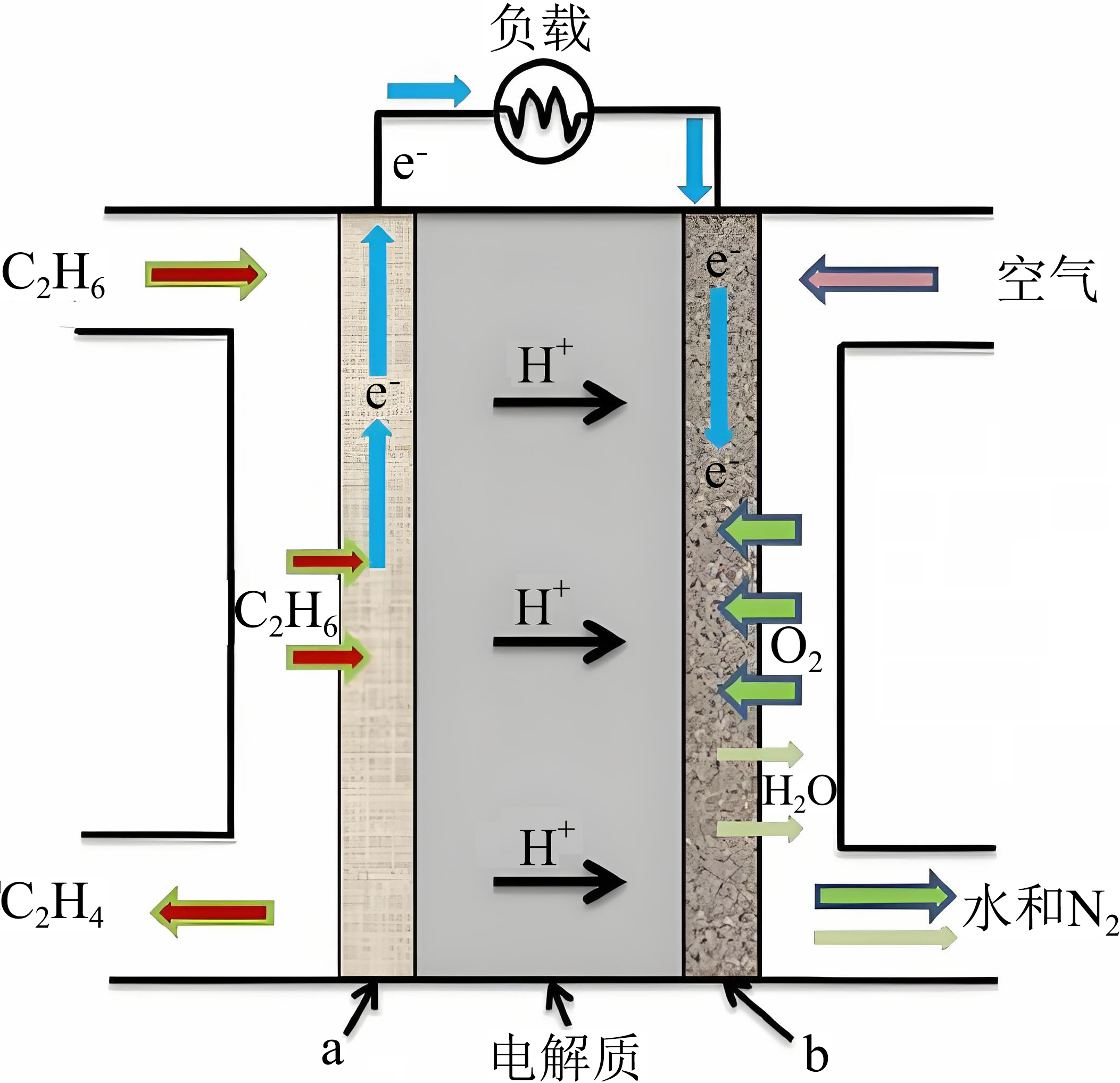
正极 ; $\\rm C_{2}H_{6}-2e^{-}=C_{2}H_{4}+2H^{+}$
"]]该装置为原电池,由电子的移动方向,以及氢离子的移动方向可知,左侧$\rm a$为负极,右侧$\rm b$为正极,负极上$\rm {{\text{C}}_{2}}{{\text{H}}_{6}}$失去电子发生氧化反应生成$\rm {{\text{C}}_{2}}{{\text{H}}_{4}}$,电极反应为$\rm {{\text{C}}_{2}}{{\text{H}}_{6}}-2{{\text{e}}^{-}}={{\text{C}}_{2}}{{\text{H}}_{4}}+2{{\text{H}}^{+}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
