高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
分银渣是一种含有银的工业废渣,主要成分为$\rm AgCl$。为了回收银,在一定温度下,采用$\rm Na_{2}SO_{3}$溶液浸取分银渣,生成可溶性的亚硫酸银络合物,反应原理为:$\rm AgCl(s)\rm +\rm 2SO_{\text{3}}^{\text{2}-}\rightleftharpoons \rm [Ag(SO_{3})_{2}]^{3-}\rm +\rm Cl^{-}$。
下列关于$\rm Na_{2}SO_{3}$溶液说法正确的是$(\qquad)$
$c{\\rm (SO_{\\text{3}}^{\\text{2}-} )} \\gt c{\\rm (H_{2}SO_{3})} \\gt c\\rm (HSO_{3}^{-}\\rm )$
","$\\dfrac{{{{c}}^{2}}(\\text{O}{{\\text{H}}^{-}})-{{{K}}_{\\text{w}}}}{{c}(\\text{O}{{\\text{H}}^{-}})}={ c\\rm (H_{2}SO_{3})} + c\\rm (HSO_{3}^{-}\\rm )$
","$ c {\\rm(Na^{+})} + c{\\rm(H^{+})} \\gt 2c{\\rm(HSO_{3}^{-} )} + 2c{\\rm(SO_{\\text{3}}^{\\text{2}-}\\rm )}$
","$ c{\\rm(H_{2}SO_{3})} + c{\\rm(HSO_{3}^{-}\\rm )} + c{\\rm(SO_{\\text{3}}^{\\text{2}-}\\rm )} = 2c{\\rm(Na^{+})}$
"]$\rm A$.一级水解大于二级水解,故$c(\text{SO}_{\text{3}}^{\text{2}-} ) \gt c(\text{HSO}_{3}^{-} ) \gt c\rm (H_{2}SO_{3})$,$\rm A$错误;
$\rm B$.电荷守恒:${2c}\left( \text{SO}_{\text{3}}^{\text{2-}} \right){+c}\left( \text{O}{{\text{H}}^{-}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right){=c}\left( {{\text{H}}^{+}} \right){+c}\left( \text{N}{{\text{a}}^{+}} \right)$,物料守恒:${c}\left( \text{N}{{\text{a}}^{+}} \right)=2\left[ {c}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right){+c}\left( \text{SO}_{\text{3}}^{\text{2-}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right) \right]$,两式相减得:${c}\left( \text{O}{{\text{H}}^{-}} \right) {-c}\left( {{\text{H}}^{+}} \right)=2{c}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right)\Rightarrow \dfrac{{{{c}}^{2}}(\text{O}{{\text{H}}^{-}})-{{{K}}_{\text{w}}}}{{c}(\text{O}{{\text{H}}^{-}})}=2{c}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right)$,$\rm B$错误;
$\rm C$.${c}\left( \text{N}{{\text{a}}^{+}} \right)=2\left[ {c}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right){+c}\left( \text{SO}_{\text{3}}^{\text{2-}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right) \right]$,可得${c}\left( \text{N}{{\text{a}}^{+}} \right)\gt 2\left[ {c}\left( \text{SO}_{\text{3}}^{\text{2-}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right) \right]$,故$ c {\rm(Na^{+})} + c{\rm(H^{+})} \gt 2c{\rm(HSO_{3}^{-} )} + 2c{\rm(SO_{\text{3}}^{\text{2}-}\rm )}$,$\rm C$正确;
$\rm D$.物料守恒:${c}\left( \text{N}{{\text{a}}^{+}} \right)=2\left[ {c}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right){+c}\left( \text{SO}_{\text{3}}^{\text{2-}} \right){+c}\left( \text{HSO}_{\text{3}}^{-} \right) \right]$,$\rm D$错误;
故选:$\rm C$;
下列关于分银渣中银浸取原理说法正确的是 。
亚硫酸钠溶液的作用是氧化剂
","为了提高银的浸取率,可以适当增大亚硫酸钠溶液的浓度
","该反应的平衡常数表达式为:$ {K}=\\rm \\dfrac{[\\text{Ag(S}{{\\text{O}}_{\\text{3}}})_{2}^{3-}][\\text{C}{{\\text{l}}^{-}}]}{[ {AgCl } ] [ { SO}_{3}^{2-}{{]}^{2}}}$
","反应过程中溶液的$\\rm pH$逐渐升高
"]$\rm A$.反应原理为:$\rm AgCl(s) + 2SO_{{3}}^{{2}-}\rightleftharpoons \rm [Ag(SO_{3})_{2}]^{3-} + Cl^{-}$,无化合价变化,非氧化还原反应,$\rm A$错误;
$\rm B$.适当增大亚硫酸钠溶液的浓度,平衡正向移动,提高银的浸取率,$\rm B$正确;
$\rm C$.该反应的平衡常数表达式为:${K}=\rm \dfrac{[{\rm Ag(S}{\rm {{O}}_{{3}}})_{2}^{3-}][{\rm C}{{\rm {l}}^{-}}]} {{{[{ SO}_{3}^{2-}]}^{2}}}$,$\rm C$错误;
$\rm D$.反应过程中溶液的$\rm SO_{{3}}^{{2}-}$生成络合物,浓度降低,$\rm {SO}_{3}^{2-}$水解逆向移动,$\rm pH$逐渐减小,$\rm D$错误;
故选:$\rm B$;
某实验小组研究分银渣浸取银的工艺条件,设计了以下实验。
实验$\rm 1$:取初始浓度相同的$\rm Na_{2}SO_{3}$溶液,测定不同温度下银的浸出率,结果如下图。
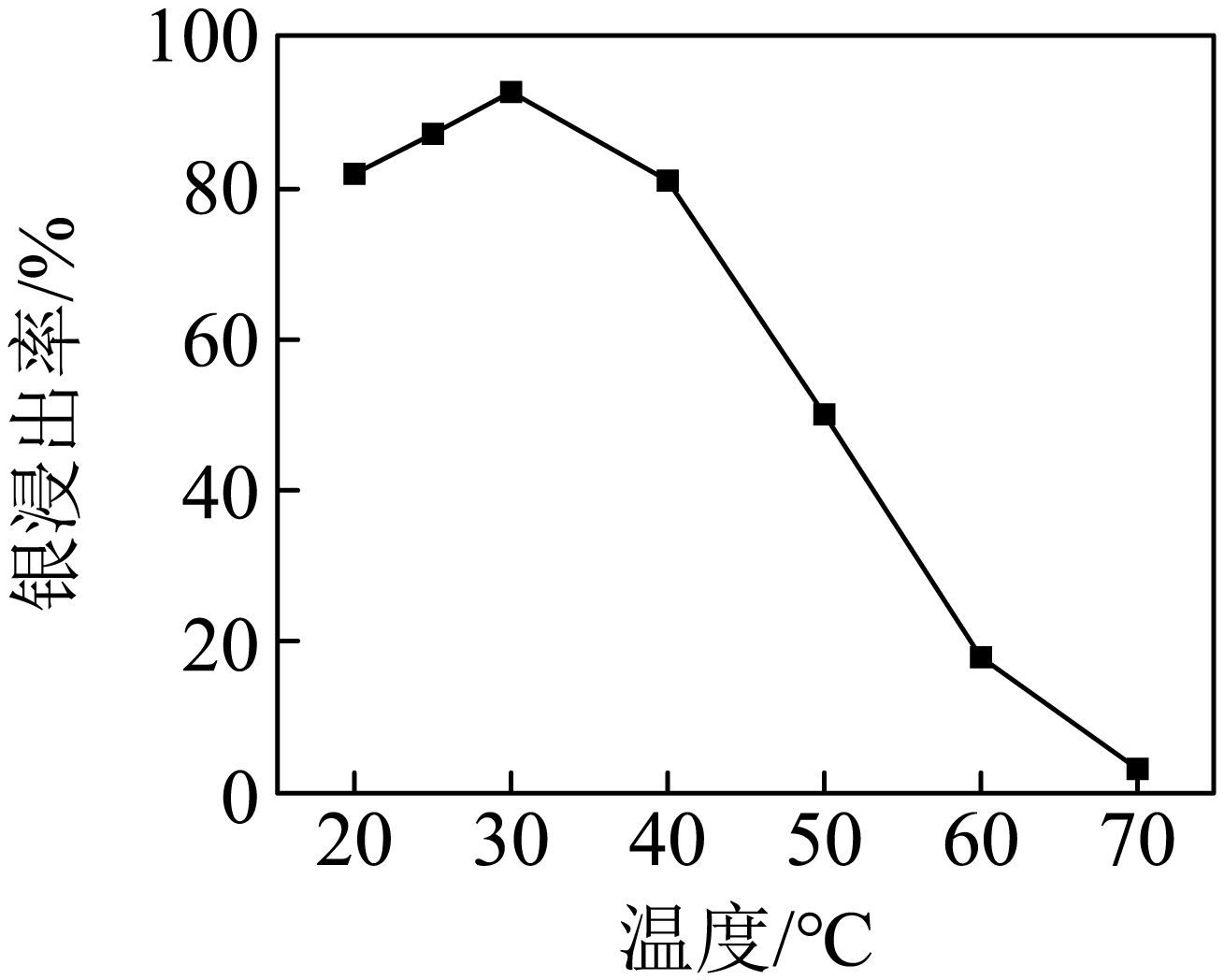
温度超过$\rm 30\;\rm ^\circ\rm C$ 后,浸取率明显下降的可能原因 。
温度超过$\rm 30\;\rm ^\circ\rm C$ 后,浸取率明显下降的可能原因:温度超过$\rm 30\;\rm ^\circ\rm C$后,$\rm [Ag(SO_{3})_{2}]^{3-}$可能分解,导致银浸出率下降$\rm ($合理即可$\rm )$
实验$\rm 2$:将初始浓度相同的$\rm Na_{2}SO_{3}$溶液加入一定量的 $\rm AgCl$ 中,测定不同$\rm pH$时银的浸出率。结果如图所示。
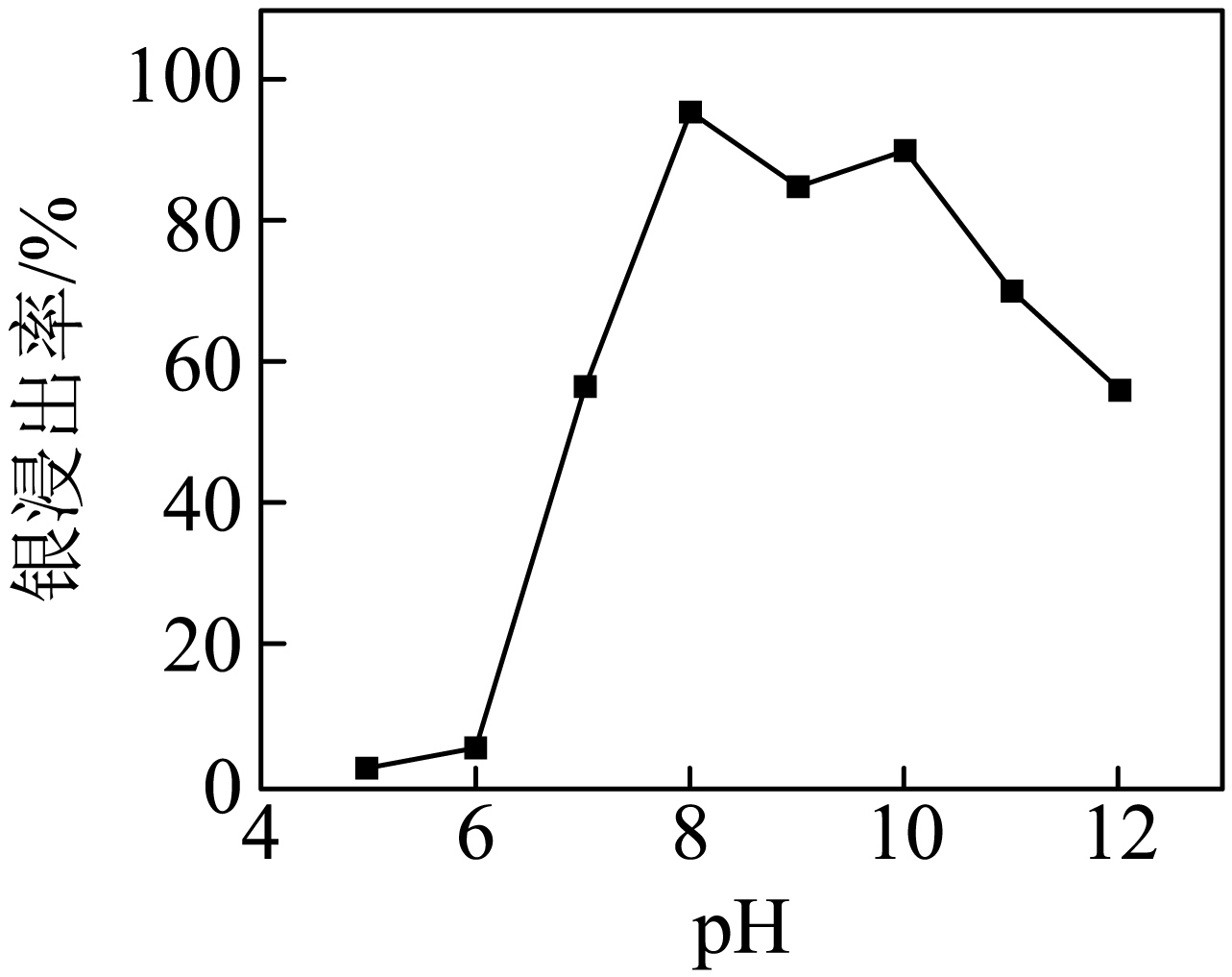
实验$\rm 2$的结果表明,$\rm pH$在$\rm 7$以下时银浸出率很低,请解释原因 。
$\rm pH$在$\rm 7$以下时银浸出率很低,原因为:$\rm pH$在$\rm 7$以下时,$ {c}\left( {{\text{H}}^{+}} \right)$较大,$\rm SO_{\text{3}}^{\text{2}-}$与$\rm H^{+}$结合转化为$\rm HSO_{3}^{-}$或$\rm H_{2}SO_{3}$,所以溶液中的$\rm SO_{\text{3}}^{\text{2}-}$浓度降低,导致银浸出率不佳。
高中 | 化学平衡常数题目答案及解析(完整版)
