高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用备受关注。一种综合利用甲烷、二氧化碳、水蒸气制备水煤气的方程式如下所示:
反应${\rm I\ \text{C}{{\text{H}}_{4}}\left( \,\text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \,\text{g} \right)}\,\quad \Delta {{H}_{1}}=-206.1\,\text{ kJ}/\text{mol}$
反应${\rm II\ \text{C}{{\text{H}}_{4}}\left( \,\text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \,\text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \,\text{g} \right)}\,\quad \Delta {{H}_{2}}=-247.3\,\text{ kJ}/\text{mol}$
反应Ⅲ$\ \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \,\text{g} \right)+{{\text{H}}_{2}}\left( \,\text{g} \right)\,\quad \Delta {{H}_{3}}=+41.2\text{ }\,\text{kJ}/\text{mol}$
反应$\rm I$在 $\rm ($填“高温”“低温”“任何温度”或“任何温度都不”$\rm )$能自发进行。
任何温度
"]]反应 $\rm I$为放热且是熵增的反应,即其$\Delta H\lt 0$,$\Delta S\lt 0$,根据$\Delta G=\Delta H-T\Delta S\lt 0$,反应可以发生,则该反应在任何温度能自发进行;
在初始压强${{p}_{0}}=100\text{ kPa}$的条件下,向某恒容密闭容器中按不同物质的量之比投入$\text{C}{{\text{H}}_{4}}、\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}\text{O}$,在不同温度下反应相同时间后,提到${{\text{H}}_{2}}$产率如图所示$\rm ({{\text{H}}_{2}}$产率$=\left. \dfrac{2{{n}_{生成}}\left( {{\text{H}}_{2}} \right)}{4{{n}_{投入}}\left( \text{C}{{\text{H}}_{4}} \right)+2{{n}_{投入}}\left( {{\text{H}}_{2}}\text{O} \right)} \right)$。
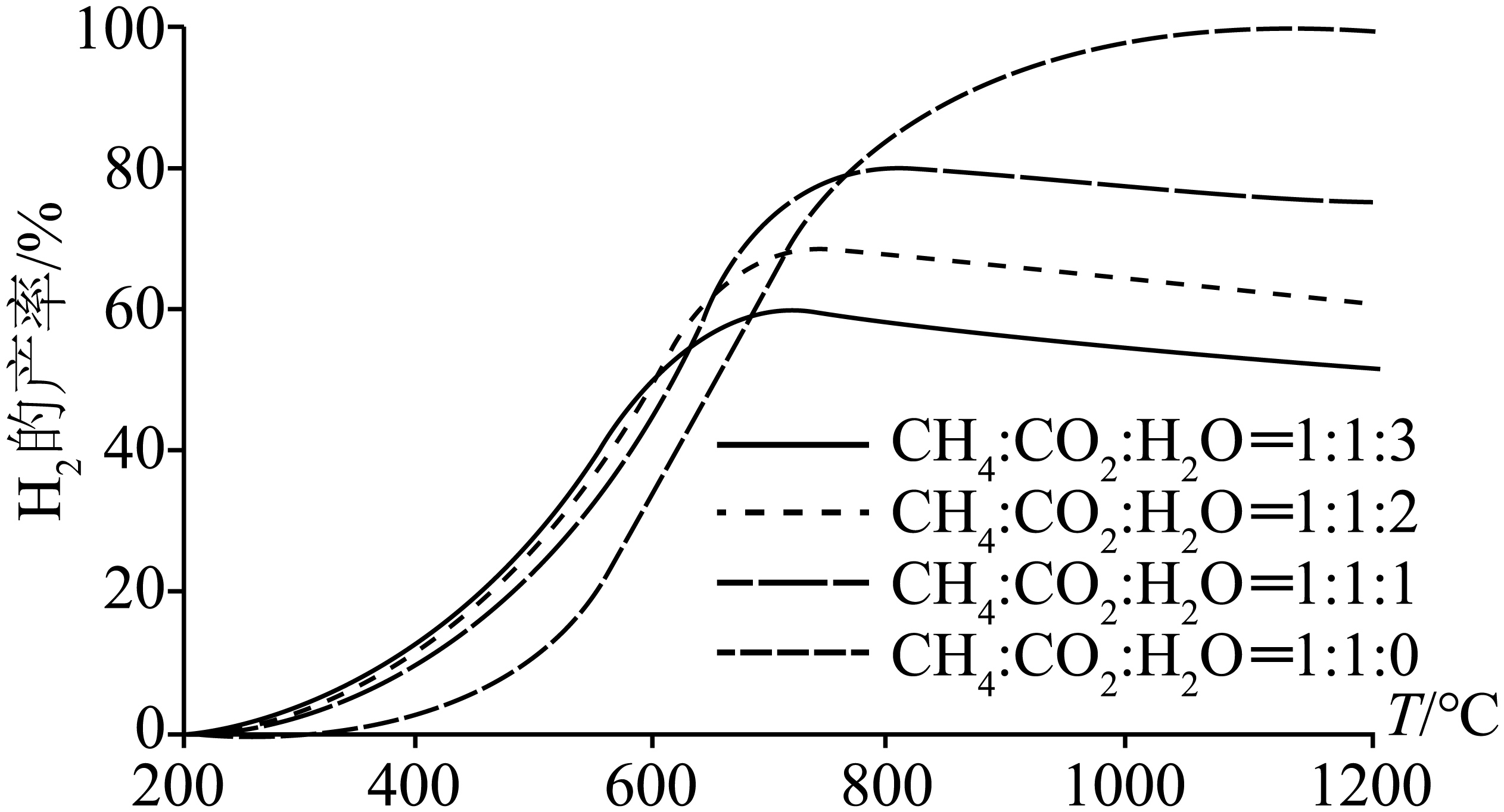
①四条曲线先升高后降低,降低的原因是 。
②由图可知,当$1000\ {}^\circ \text{C}$,$\text{C}{{\text{H}}_{4}}:\text{C}{{\text{O}}_{2}}:{{\text{H}}_{2}}\text{O}=1:1:0$时,${{\text{H}}_{2}}$产率接近$100\%$,随着${{\text{H}}_{2}}\text{O}$的投入增加,${{\text{H}}_{2}}$产率降低的原因是
③在$\text{C}{{\text{H}}_{4}}:\text{C}{{\text{O}}_{2}}:{{\text{H}}_{2}}\text{O}=1:1:3$的条件下,已知温度为$T$时,$\text{C}{{\text{H}}_{4}}$的平衡转化率为$50\%{{\text{H}}_{2}}$的平衡产率为$26\%$,则此时容器中$\text{CO}$的分压为 $\text{kPa}\rm ($保留两位有效数字$\rm )$,反应$\rm III$的分压平衡常数${{K}_{\text{p}}}=$ $\rm ($保留两位有效数字$\rm )$。
反应体系已达平衡,反应$\\rm I$和$\\rm II$均为放热反应,温度越高平衡逆向移动 ; $1000\\ {}^\\circ \\text{C}$时,反应$\\rm I$和$\\rm II$处于平衡状态,反应$\\rm I$的程度小于反应$\\rm II$ ; $\\rm 14$ ; $\\rm 0.55$
"]]①温度越高反应速率越快,则相同的时间内,温度较高时,反应可以达到平衡,且可以发生移动,在反应 $\rm I$ 和 $\rm II$ 中氢气是产物,平衡后平衡逆向移动,其产率会降低;
②由图可知,当 $1000\ {}^\circ \text{C}$时,该反应已经达到平衡,当水的投入量为$\rm 0$时,${{\text{H}}_{2}}$ 产率接近 $100\%$,说明此时反应 $\rm I$ 的程度小于反应$\rm II$,加入水后,反应$\rm I$开始反应,但是程度较小,根据氢气产率定义可知其产率降低;
③设$\rm CH_{4}$、$\rm CO_{2}$、$\rm H_{2}O$的物质的量分别为$x$、$x$、$3x$,设参加反应$\rm I$的甲烷的物质的量为$a$ $\rm mol$,$\text{C}{{\text{H}}_{4}}$的平衡转化率为$50\%$,${{\text{H}}_{2}}$的平衡产率为$26\%$,可得以下三段式:
$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right) & + & \text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\开始 \text{(mol)} & x & {} & 3x & {} & \text{0} & {} & \text{0} \\转化 \text{(mol)} & a & {} & a & {} & a & {} & 3a \\ 平衡\text{(mol)} & x-a & {} & 3x-a & {} & a & {} & 3a \\ \end{matrix}$
$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{2CO}\left( \text{g} \right) & + & \text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\开始 \text{(mol)} & x-a & {} & x & {} & a & {} & 3a \\ 转化\text{(mol)} & 0.5x-a & {} & 0.5x-a & {} & x-2a & {} & x-2a \\平衡 \text{(mol)} & 0.5x & {} & 0.5x+a & {} & x-a & {} & x+a \\ \end{matrix}$
$26\%=\dfrac{2n({{\text{H}}_{2}})}{4x+2\times 3x}$,解得$n\left( {{\text{H}}_{\text{2}}} \right)=1.3x$;
$\begin{matrix} {} & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\left( \text{g} \right) \\开始 \text{(mol)} & x-a & {} & 3x-a & {} & 0.5x+a & {} & x+a \\ 转化\text{(mol)} & 0.3x-a & {} & 0.3x-a & {} & 0.3x-a & {} & 1.3x-(x+a)=0.3x-a \\平衡 \text{(mol)} & 0.7x & {} & 2.7x & {} & 0.8x & {} & 1.3x \\ \end{matrix}$
由于是恒容容器,则平衡时的压强,${{P}_{平}}=\dfrac{0.7x+2.7x+0.8x+1.3x+0.5x}{x+x+3x}\times 100\text{ kPa}=\dfrac{6}{5}\times 100\text{ kPa}$,
则此时容器中$\text{CO}$的分压为$\dfrac{0.7x}{0.7x+2.7x+0.8x+1.3x+0.5x}\times \dfrac{6}{5}\times 100\text{ kPa}=14\text{ kPa}$;
由于反应$\rm III$是气体分子数不变的反应,可以用物质的量来计算分压平衡常数${{K}_{\text{p}}}=\dfrac{0.8x\times 1.3x}{0.7x\times 2.7x}=0.55$;
利用电催化法将$\text{C}{{\text{O}}_{2}}$转化为$\text{C}{{\text{H}}_{3}}\text{OH}$的一种方法如图:
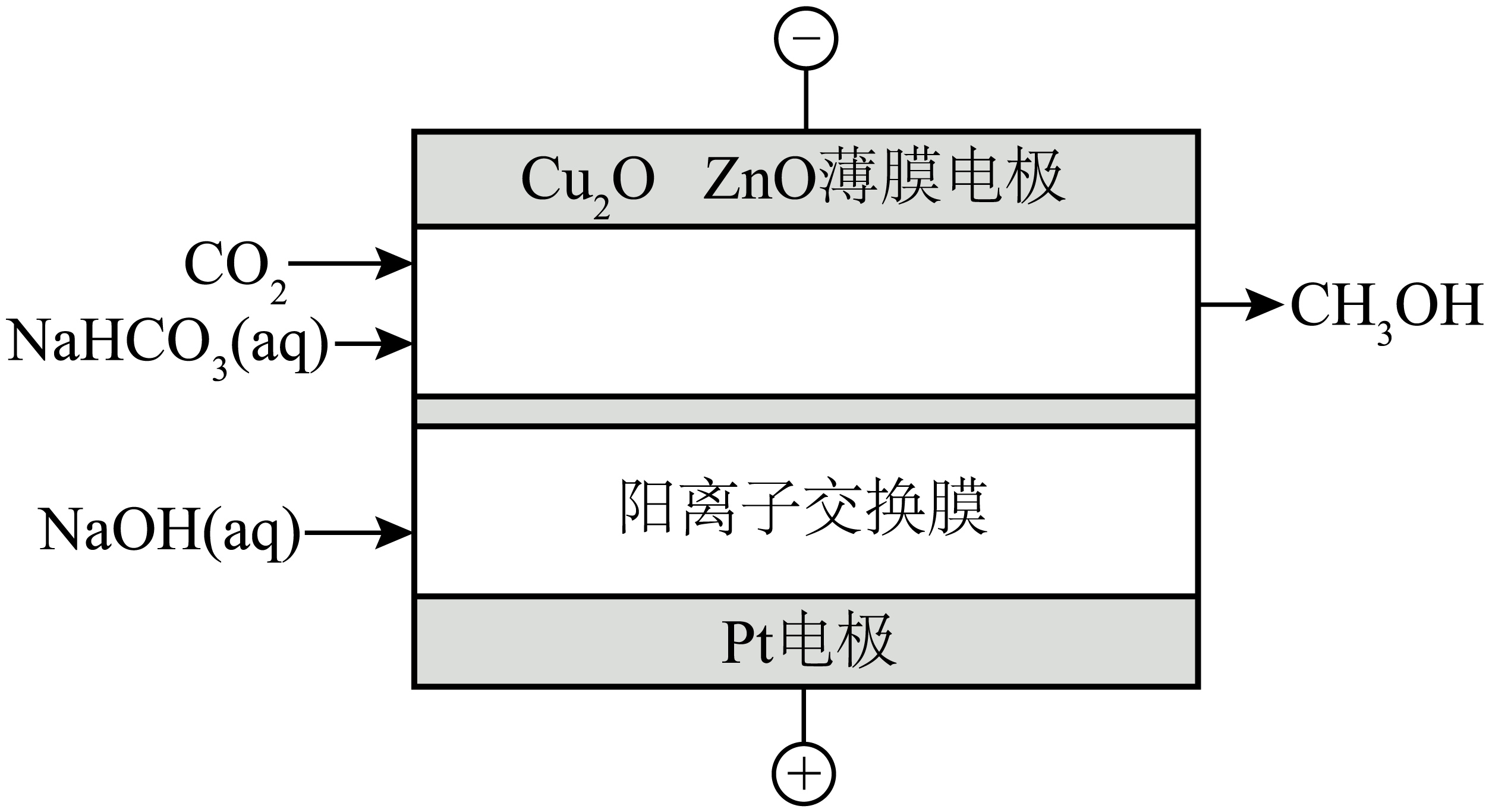
①阴极发生的反应方程式为 。
②当生成$16\ \text{g}$甲醇时,阳极区质量减少 $\operatorname{g}$。
$\\text{C}{{\\text{O}}_{2}}+6{{\\text{e}}^{-}}+6\\text{HCO}_{3}^{-}=\\text{C}{{\\text{H}}_{3}}\\text{OH}+{{\\text{H}}_{2}}\\text{O}+6\\text{CO}_{3}^{2-}$ ; $\\rm 93$
"]]①二氧化碳在阴极发生还原反应,则电极反应为:$\text{C}{{\text{O}}_{2}}+6{{\text{e}}^{-}}+6\text{HCO}_{3}^{-}=\text{C}{{\text{H}}_{3}}\text{OH}+{{\text{H}}_{2}}\text{O}+6\text{CO}_{3}^{2-}$;
②阳极区反应为$\rm 4OH^{-}-4e^{-}=2H_{2}O+O_{2}↑$,同时会有$\rm 4$个钠离子向阴极移动,则当生成$16\ \text{g}$甲醇时,即$\rm 0.5\;\rm mol$甲醇生成时,会转移$\rm 3$ $\rm mol$电子,生成$\rm 0.75$ $\rm mol$氧气,同时会有$\rm 3$ $\rm mol$钠离子向阴极移动,质量减少$\rm 0.75$ $\rm mol\times 32$ $\rm g/mol+3$ $\rm mol\times 23$ $\rm g/mol=93$ $\rm g$。
高中 | 化学平衡常数题目答案及解析(完整版)
