高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
为实现氯资源循环利用,工业上采用 $\text{Ru}{{\text{O}}_{2}}$ 催化氧化法处理 $\text{HCl}$ 废气: $2\text{HCl}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \ \text{g} \right)\rightleftharpoons \text{C}{{\text{l}}_{2}}\left( \ \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\ \quad \Delta {{H}_{1}}=-57.2\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ 。将 $\text{HCl}$ 和 ${{\text{O}}_{2}}$ 分别以不同起始流速通入反应器中,在 $360\ {}^\circ \text{C}$ 、 $400\ {}^\circ \text{C}$ 和 $440\ {}^\circ \text{C}$ 下反应,通过检测流出气成分绘制 $\text{HCl}$ 转化率 $\left( \alpha \right)$ 曲线,如图所示 $\rm ($较低流速下转化率可近似为平衡转化率$\rm )$。下列说法错误的是$(\quad\ \ \ \ )$
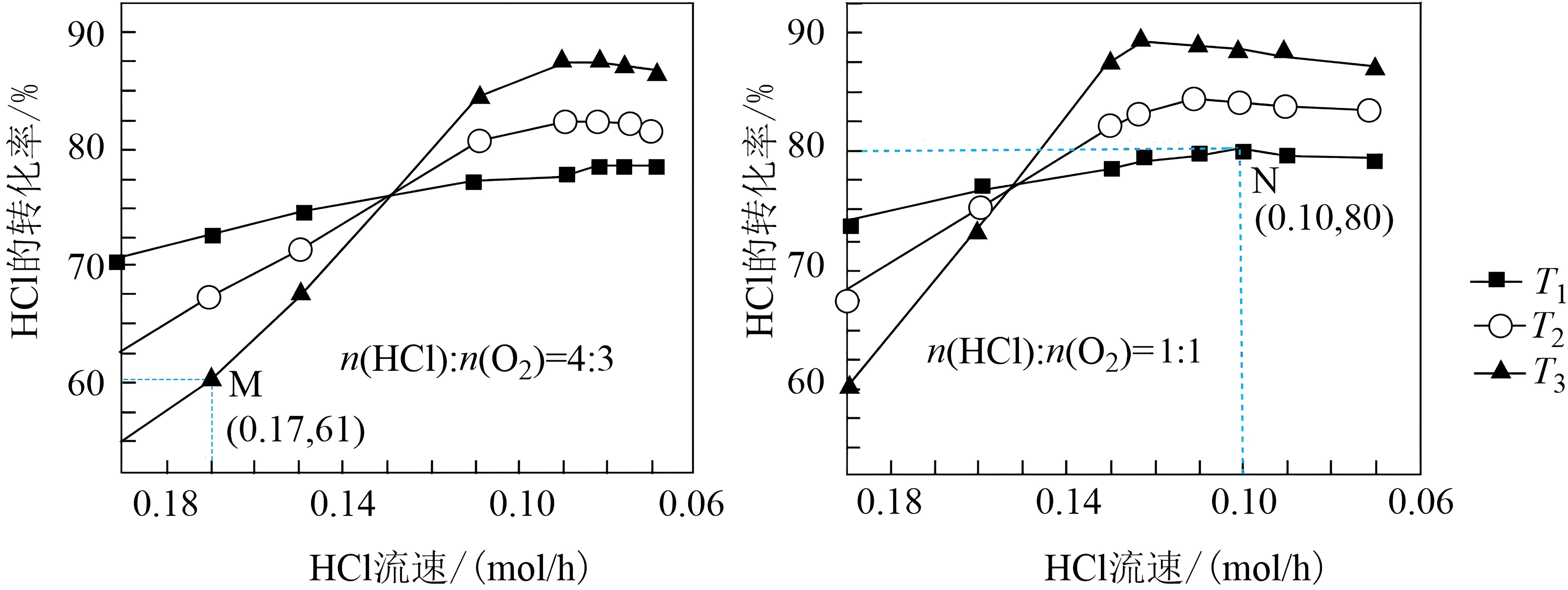
流速较高时,反应物分子进入反应体系时间较短,化学反应速率是影响 $\\text{HCl}$ 转化率的主要因素
","${{T}_{1}}$ 代表的温度为 $440\\ {}^\\circ \\text{C}$
","相同条件下,将温度升高 $40\\ {}^\\circ \\text{C}$ 或使用更高效的催化剂可提高 $\\operatorname{M}$ 点 $\\text{HCl}$ 转化率
","$\\operatorname{N}$ 点的转化率为平衡转化率,则该温度下反应的物质的量分数平衡常数 $K=36$
"]反应$2\text{HCl}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \ \text{g} \right)\rightleftharpoons \text{C}{{\text{l}}_{2}}\left( \ \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{\text{1}}}=-57.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,该反应为放热反应,由于在流速较低时的转化率视为平衡转化率,所以在流速低时,温度越高,$\rm HCl$的转化率越小,故${{T}_{1}}$代表的温度为$440\ {}^\circ \text{C}$,${{T}_{3}}$为$360\ {}^\circ \text{C}$。
$\rm A$.流速过快时,反应物分子进入反应体系时间较短,反应未达到平衡状态,化学反应速率是影响$\text{HCl}$转化率的主要因素,$\rm A$正确;
$\rm B$.根据分析,${{T}_{1}}$代表的温度为$440\ {}^\circ \text{C}$,${{T}_{3}}$为$360\ {}^\circ \text{C}$,$\rm B$正确;
$\rm C$.$\rm M$对应温度为$360\ {}^\circ \text{C}$,由图像可知,升高温度,$\rm HCl$的转化率增大,使用高效催化剂,可以增大该温度下的反应速率,使单位时间内$\rm HCl$的转化率增加,$\rm C$正确;
$\rm D$.$\rm N$点时,$\rm HCl$的平衡转化率为$\rm 80\%$,$n\left( \text{HCl} \right):n\left( {{\text{O}}_{2}} \right)=1:1$,设$n\left( \text{HCl} \right)=n\left( {{\text{O}}_{\text{2}}} \right)=1\text{ mol}$,根据三段式:$\begin{matrix} {} & \text{2HCl(g)+} & \dfrac{1}{2}{{\text{O}}_{\text{2}}}\text{(g)} & \rightleftharpoons & \text{C}{{\text{l}}_{\text{2}}}\text{(g)+} & {{\text{H}}_{\text{2}}}\text{O(g)} \\起始 \text{/mol} & 1 & 1 & {} & 0 & 0 \\ 转化\text{/mol} & 0.8 & 0.2 & {} & 0.4 & 0.4 \\ 平衡\text{/mol} & 0.2 & 0.8 & {} & 0.4 & 0.4 \\ \end{matrix}$
物质的量分数平衡常数为:$K=\dfrac{\dfrac{0.4}{1.8}\times \dfrac{0.4}{1.8}}{{{\left( \dfrac{0.2}{1.8} \right)}^{2}}\times {{\left( \dfrac{0.8}{1.8} \right)}^{\dfrac{1}{2}}}}=6$,$\rm D$错误;
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
