| 离子方程式 题目答案及解析
稿件来源:高途
| 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
氢碘酸常用于合成碘化物。某化学兴趣小组用如图装置$\rm ($夹持装置等略$\rm )$制备氢碘酸。
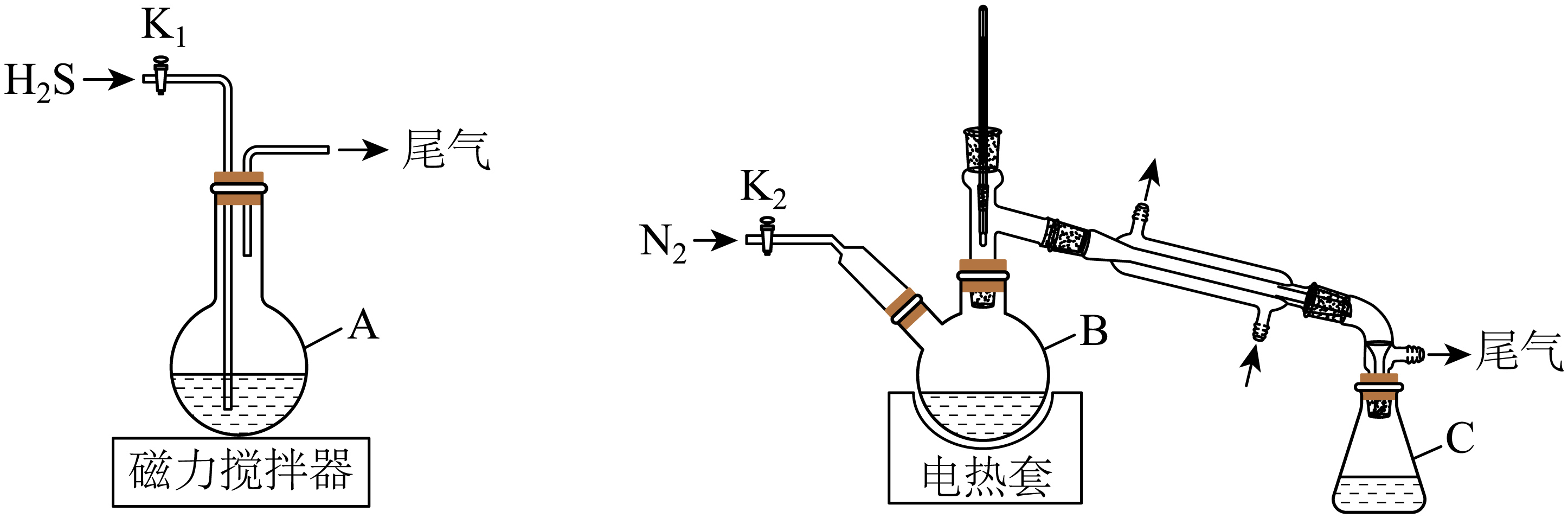
步骤如下:
ⅰ.在$\rm A$中加入$\rm 150\ mL\ {{H}_{2}}O$和$\rm 127\ g\ {{I}_{2}}$,快速搅拌,打开$\rm {{K}_{1}}$通入$\rm {{H}_{2}}S$,反应完成后,关闭$\rm {{K}_{1}}$,静置、过滤得滤液;
ⅱ.将滤液转移至$\rm B$中,打开$\rm {{K}_{2}}$通入$\rm {{N}_{2}}$,接通冷凝水,加热保持微沸,直至$\rm {{H}_{2}}S$除尽;
ⅲ.继续加热蒸馏,$\rm C$中收集沸点为$\rm 125\sim127\ ^\circ \text{C}$间的馏分,得到$\rm 117\ mL$氢碘酸$\rm ($密度为$\rm 1.7\ g\cdot m{{L}^{-1}}$,$\rm HI$质量分数为$\rm 57\%)$。
回答下列问题:
仪器$\rm A$的名称: ,通入$\rm {{H}_{2}}S$发生反应的化学方程式: 。
圆底烧瓶; $\\rm I_{2}+H_{2}S=S+2HI$
"]]仪器$\rm A$的名称为圆底烧瓶;$\rm I_{2}$的氧化性比$\rm S$强,通入$\rm {{H}_{2}}S$发生反应的化学方程式为$\rm I_{2}+H_{2}S=S↓+2HI$;
步骤ⅰ中快速搅拌的目的: $\rm ($填序号$\rm )$
$\rm a$.便于产物分离
$\rm b$.防止暴沸
$\rm c$.防止固体产物包覆碘
$\\rm c$
"]]$\rm I_{2}$在水中的溶解度较小,生成的$\rm S$可能包裹在其表面阻止反应的继续进行,故步骤ⅰ中快速搅拌的目的是防止固体产物包覆碘,选$\rm c$;
步骤ⅰ中随着反应的进行,促进碘溶解的原因 $\rm ($用离子方程式表示$\rm )$。
$\\rm {{I}_{2}}+{{I}^{-}}\\rightleftharpoons I_{3}^{-}$
"]]$\rm I_{2}$和$\rm I^{-}$会发生反应:$\rm {{I}_{2}}+{{I}^{-}}\rightleftharpoons I_{3}^{-}$,步骤ⅰ中随着反应的进行,生成的$\rm HI$电离出的$\rm I^{-}$与$\rm I_{2}$反应促进$\rm I_{2}$的溶解。
步骤ⅱ中的尾气常用 $\rm ($填化学式$\rm )$溶液吸收。
$\\rm NaOH$
"]]步骤ⅱ中的尾气为$\rm {{H}_{2}}S$,有毒,是酸性气体,常用$\rm NaOH$溶液吸收;
步骤ⅱ实验开始时的操作顺序:先通入$\rm {{N}_{2}}$,再加热;步骤ⅲ实验结束时相对应的操作顺序: 。
先停止加热,再通一段时间的$\\rm N_{2}$后关闭$\\rm K_{2}$
"]]为确保蒸馏装置内的$\rm HI$全部进入$\rm C$中,步骤ⅲ实验结束时相对应的操作顺序为:先停止加热,再通一段时间的$\rm N_{2}$后关闭$\rm K_{2}$;
列出本实验产率的计算表达式: 。
$\\rm \\dfrac{117\\times 1.7\\times 57}{128}\\%$
"]]$\rm 127\ g\ I_{2}$的物质的量为$\rm 0.5\ mol$,$n_{理论}\rm (HI)=2\times 0.5\ mol=1\ mol$,$m_{理论}\rm (HI)=1\ mol\times 128\ g/mol=128\ g$、$m_{实际}\rm (HI)=117\ mL\times 1.7\ g/mol\times 57 \%$,故$\rm HI$的产率$\rm =$ $\rm \dfrac{117\ mL\times 1.7\ g/mol\times 57 \%}{128\ g}\times 100\%=\dfrac{117\times 1.7\times 57 \%}{128}\times 100\%=\dfrac{117\times 1.7\times 57}{128}\%$;
氢碘酸见光易分解,易被空气氧化,应保存在 。
密封的棕色细口瓶中,并放在避光低温处
"]]氢碘酸见光易分解,易被空气氧化,应保存在密封的棕色细口瓶中,并放在避光低温处。
| 离子方程式题目答案及解析(完整版)
