高中 | 氧化反应、还原反应 题目答案及解析
稿件来源:高途
高中 | 氧化反应、还原反应题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化反应、还原反应
富集海水中锂的电化学系统如图所示,工作步骤如下:
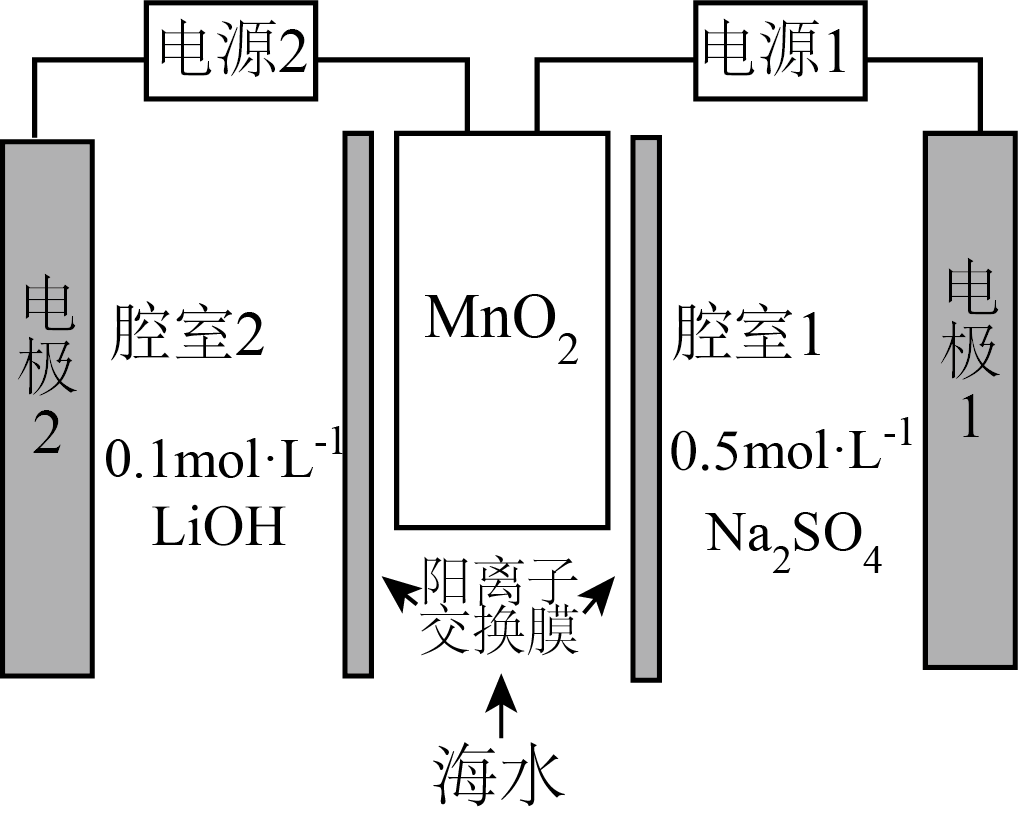
①启动电源$\rm 1$,$\text{Mn}{{\text{O}}_{2}}$所在腔室的$\text{L}{{\text{i}}^{+}}$进入$\text{Mn}{{\text{O}}_{2}}$结构而形成$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{2}}{{\text{O}}_{4}}$。
②关闭电源$\rm 1$和海水通道,启动电源$\rm 2$,使$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{2}}{{\text{O}}_{4}}$中的$\text{L}{{\text{i}}^{+}}$脱出进入腔室$\rm 2.$
关于该电化学系统的说法正确的是$(\quad\ \ \ \ )$
启动电源$\\rm 1$时,电极$\\rm 1$为阴极
","启动至关闭电源$\\rm 1$,若转化的$n\\left( \\text{Mn}{{\\text{O}}_{2}} \\right)$与生成的$n\\left( {{\\text{O}}_{2}} \\right)$之比为$20:3$,可得$\\text{L}{{\\text{i}}_{x}}\\text{M}{{\\text{n}}_{2}}{{\\text{O}}_{4}}$中的$x=1.2$
","启动电源$\\rm 2$时$\\text{Mn}{{\\text{O}}_{2}}$电极反应式为$x\\text{L}{{\\text{i}}^{+}}+2\\text{Mn}{{\\text{O}}_{2}}+x{{\\text{e}}^{-}}=\\text{L}{{\\text{i}}_{x}}\\text{M}{{\\text{n}}_{2}}{{\\text{O}}_{4}}$
","电化学系统降低了腔室$\\rm 2$中$\\rm LiOH$的浓度
"]由①可知,启动电源$\rm 1$,$\text{Mn}{{\text{O}}_{\text{2}}}$所在腔室的$\rm Li^{+}$进入$\text{Mn}{{\text{O}}_{\text{2}}}$结构而形成$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}$,可知$\text{Mn}{{\text{O}}_{\text{2}}}$中$\rm Mn$元素的化合价降低,为阴极,电极反应式为$x\text{L}{{\text{i}}^{+}}\text{+2Mn}{{\text{O}}_{\text{2}}}+x{{\text{e}}^{-}}\text{=L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}$,电极$\rm 1$为阳极,连接电源正极;②关闭电源$\rm 1$和海水通道,启动电源$\rm 2$,使$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}$中的$\text{L}{{\text{i}}^{+}}$脱出进入腔室$\rm 2$,可知,电极$\rm 2$为阴极,电极反应式为:$\text{2}{{\text{H}}_{\text{2}}}\text{O+}{{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{=4O}{{\text{H}}^{-}}$;阳极的电极反应式为:$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}-x{{\text{e}}^{-}}=x\text{L}{{\text{i}}^{+}}\text{+2Mn}{{\text{O}}_{\text{2}}}$,以此分析解题。
$\rm A$.由分析可知,室Ⅰ中电极Ⅰ连接电源Ⅰ的正极,作阳极,发生氧化反应,故$\rm A$错误;
$\rm B$.根据分析可知,启动至关闭电源$\rm 1$,转化的$n(\text{Mn}{{\text{O}}_{\text{2}}}\rm )$与生成的$n({{\text{O}}_{\text{2}}}\rm )$之比为$\rm 20$:$\rm 3$,设生成的氧气为$\rm 3$ $\rm mol$,转移电子为$\rm 12\;\rm mol$,根据阳极的电极反应式:$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}-x{{\text{e}}^{-}}=x\text{L}{{\text{i}}^{+}}\text{+2Mn}{{\text{O}}_{\text{2}}}$,结合电子守恒,可知$\rm 2$ $\rm mol\ \text{Mn}{{\text{O}}_{\text{2}}}$生成时转移$\rm 1.2\;\rm mol$电子,可得$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}$中的$x=1.2$,故$\rm B$正确;
$\rm C$.启动电源$\rm 2$时,$\text{Mn}{{\text{O}}_{\text{2}}}$电极是阳极,电极反应式为:$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}-x{{\text{e}}^{-}}=x\text{L}{{\text{i}}^{+}}\text{+2Mn}{{\text{O}}_{\text{2}}}$,故$\rm C$错误;
$\rm D$.由分析可知,启动电源$\rm 2$,使$\text{L}{{\text{i}}_{x}}\text{M}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}$中的$\rm L{{i}^{+}}$脱出进入腔室$\rm 2$,电极$\rm 2$为阴极,电极反应式为:$\text{2}{{\text{H}}_{\text{2}}}\text{O+}{{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{=4O}{{\text{H}}^{-}}$;提高了腔室$\rm 2$中$\text{LiOH}$的浓度,故$\rm D$错误;
故选:$\rm B$
高中 | 氧化反应、还原反应题目答案及解析(完整版)
