高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
微生物电池除去废水中$\text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}$的装置如图所示。下列说法正确的是$(\qquad)$
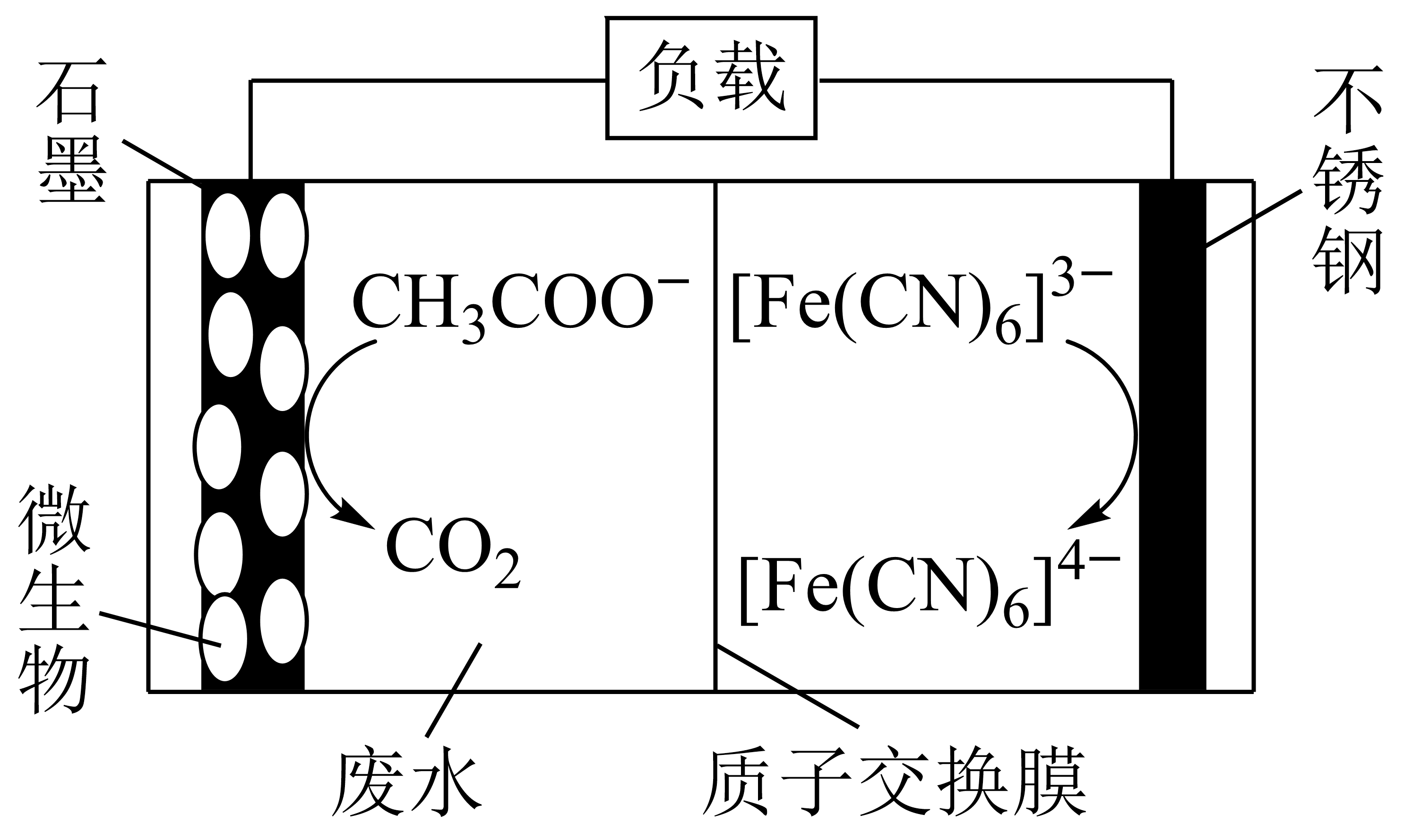
石墨电极的表面发生了还原反应
","不锈钢表面的电极反应为${{\\left[ \\text{Fe}{{\\left( \\text{CN} \\right)}_{6}} \\right]}^{3-}}-{{\\text{e}}^{-}}={{\\left[ \\text{Fe}{{\\left( \\text{CN} \\right)}_{6}} \\right]}^{{{4-}}}}$
","高温条件可以加快$\\text{C}{{\\text{H}}_{3}}\\text{CO}{{\\text{O}}^{-}}$的除去速率
","电池工作一段时间后,左侧废水的$\\rm pH$值可能会升高
"]由装置图可知,石墨电极上$\text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}}$转化生成$\rm CO_{2}$,$\rm C$元素化合价由$\rm 0$价升高为$\rm +4$价,失电子发生氧化反应,则石墨电极为负极,发生电极反应:$\text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}}\text{-8}{{\text{e}}^{-}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=2C}{{\text{O}}_{\text{2}}}\uparrow +7{{\text{H}}^{+}}$;不锈钢电极为正极,得到电子发生还原反应,电极反应:${{[\!\!\text{ Fe}{{\left( \text{CN} \right)}_{\text{6}}}]}^{\text{3-}}}+{{\text{e}}^{-}}\text{= }\!\![\!\!\text{ Fe}{{\left( \text{CN} \right)}_{\text{6}}}{{]}^{\text{4-}}}$,据此分析;
$\rm A$.该电池是原电池,正极反应:${{\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]}^{3-}}+{{\text{e}}^{-}}={{\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]}^{4-}}$,负极反应:$\text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}-8{{\text{e}}^{-}}+2{{\text{H}}_{2}}\text{O}=2\text{C}{{\text{O}}_{2}}\uparrow +7{{\text{H}}^{+}}$,石墨电极表面发生了氧化反应,$\rm A$错误;
$\rm B$.不锈钢表面的电极反应为${{\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]}^{3-}}+{{\text{e}}^{-}}={{\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]}^{4-}}$,$\rm B$错误;
$\rm C$.微生物电池不适于在高温下工作,其工作环境通常是常温,以确保微生物的活性和电池的正常运行,$\rm C$错误;
$\rm D$.左侧每消耗$1\ \text{mol\ C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}$可以生成$7\;\rm \text{mol}\ {{\text{H}}^{+}}$,但是有$8\;\rm \text{mol}\ {{\text{H}}^{+}}$从左侧通过质子交换膜移向右侧,所以左侧废水的$\rm pH$可能会升高,$\rm D$正确;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
