高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
我国科学家设计了一种新型多功能$\rm ($甲醛一硝酸盐$\rm )$电池,可同时处理废水中的甲醛和硝酸根离子,其工作原理如图所示。下列说法正确的是$(\quad\ \ \ \ )$
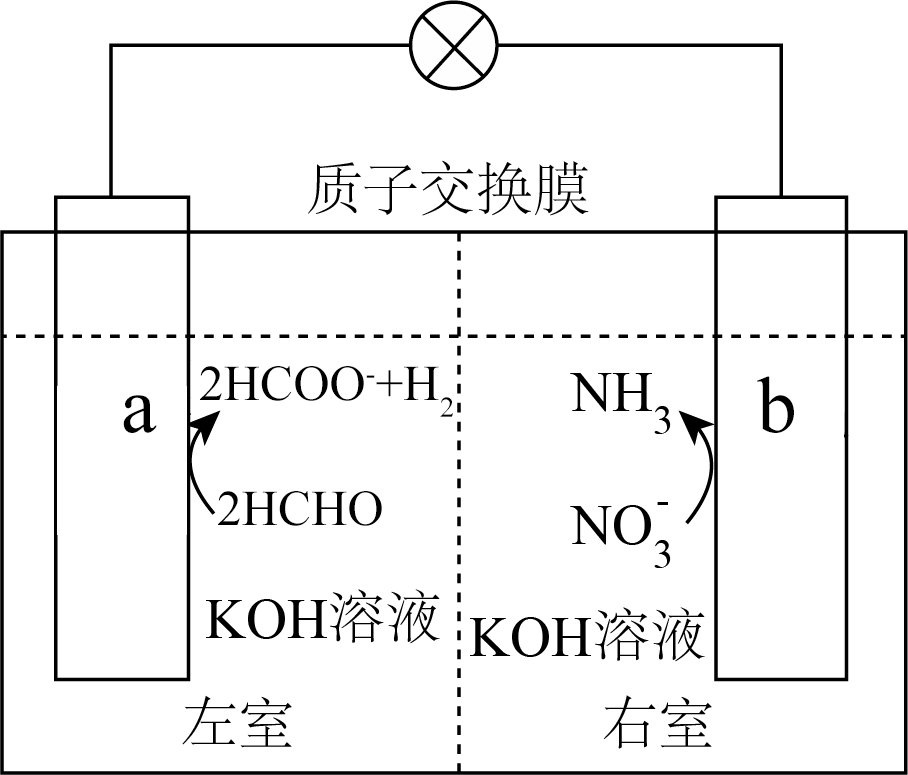
$\\rm a$电极区总反应为;$2\\text{HCHO}+4\\text{O}{{\\text{H}}^{-}}-2{{\\text{e}}^{-}}=2\\text{HCO}{{\\text{O}}^{-}}+{{\\text{H}}_{2}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}$
","电池工作时,$\\text{b}$电极电势高,电子流动的方向是$\\text{b}\\to \\text{a}$
","放电过程中,${{\\text{K}}^{+}}$从左室迁移到右室
","处理废水过程中溶液$\\rm pH$不变,无需补加$\\rm KOH$
"]由图可知,$\rm a$极$\rm HCHO$失去电子发生氧化反应生成$\rm HCOO^{-}$和$\rm H_{2}$,为负极,电极方程式为:$\rm 2HCHO+4OH^{-}-2e^{-}=2HCOO^{-}+H_{2}↑+2H_{2}O$;则$\rm b$为正极,$\rm \text{NO}_{\text{3}}^{-}$得到电子发生还原反应生成$\rm NH_{3}$,电极方程式为:$\rm \text{NO}_{\text{3}}^{-}\rm +6H_{2}O+8e^{-}=NH_{3}↑+9OH^{-}$;
$\rm A$.由分析,$\rm a$电极区总反应为;$\rm 2\text{HCHO}+4\text{O}{{\text{H}}^{-}}-2{{\text{e}}^{-}}=2\text{HCO}{{\text{O}}^{-}}+{{\text{H}}_{2}}\uparrow +2{{\text{H}}_{2}}\text{O}$,$\rm A$正确;
$\rm B$.$\rm a$为负极、$\rm b$为正极,则电池工作时,$\rm \text{b}$电极电势高,电子流动的方向是$\rm \text{a}\xrightarrow[{}]{{}}\text{b}$,$\rm B$错误;
$\rm C$.放电过程中,阳离子由负极流向正极,但中间膜为质子交换膜,则$\rm {{\text{K}}^{+}}$不能通过质子交换膜从左室迁移到右室,$\rm C$错误;
$\rm D$.由分析的正负极反应,总反应为$\rm 8HCHO+\text{NO}_{\text{3}}^{-}\rm +7OH^{-}=NH_{3}↑+8HCOO^{-}+4H_{2}↑+2H_{2}O$,处理废水过程中消耗$\rm OH^{-}$,溶液$\rm pH$减小,需补加 $\rm KOH$,$\rm D$错误;
故选:$\rm A$
高中 | 原电池工作原理题目答案及解析(完整版)
