高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
回收锂离子电池有利于环境保护、缓解金属资源短缺、促进锂离子电池产业可持续发展。一种废弃$\rm NCM$型锂离子电池回收并再生的工艺流程如下:
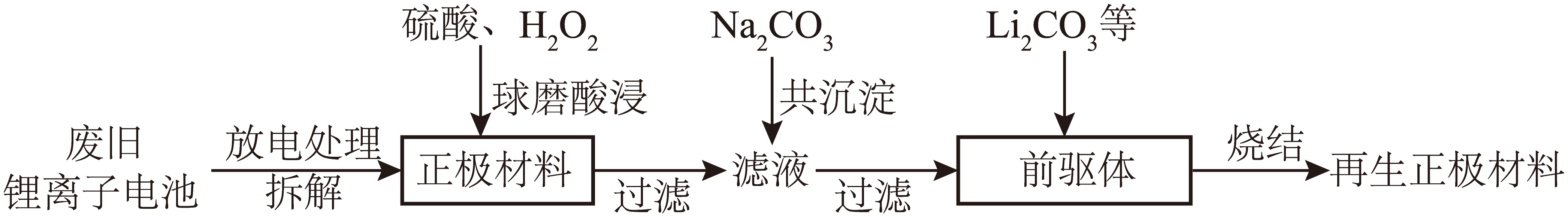
已知:
①放电后正极物质为$\rm LiN{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}{{O}_{2}}$;前驱体的主要物质为$\rm N{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}C{{O}_{3}}$。
②室温下,${{K}_{\rm sp}}\rm [{{(NiOH)}_{2}}]=4.0\times {{10}^{-16}}$、${{K}_{\rm sp}}\rm [Co{{(OH)}_{2}}]=1.6\times {{10}^{-15}}$、${{K}_{\rm sp}}\rm [Mn{{(OH)}_{2}}]=1.0\times {{10}^{-13}}$。
回答下列问题:
“放电处理”的作用是防止在拆解电池时出现短路起火等安全问题,以及 。
有利于锂离子迁移至正极,便于回收
"]]“放电处理”的作用是防止在拆解电池时出现短路起火等安全问题,以及有利于锂离子迁移至正极,便于回收;
正极材料与硫酸、$\rm {{H}_{2}}{{O}_{2}}$反应时,过氧化氢的作用是 。
还原剂(或将$\\rm Ni$、$\\rm Co$、$\\rm Mn$还原为$\\rm +2$价)
"]]正极材料与硫酸、$\rm {{H}_{2}}{{O}_{2}}$反应时,过氧化氢在酸性条件下作还原剂将$\rm Ni$、$\rm Co$、$\rm Mn$还原为$\rm +2$价,故过氧化氢的作用是作还原剂;
共沉淀时为防止生成氢氧化物,若溶液中金属离子的浓度均为$\rm 0.10\ {mol} \cdot {L}^{-1}$时,控制溶液$\rm pH$不高于 ($\rm \lg 2=0.3$)。
$\\rm 6.8$
"]]若溶液中金属离子的浓度均为$\rm 0.10 \ {mol} \cdot {L}^{-1}$,根据题意${{K}_{\rm sp}}\rm [Ni(OH{{)}_{2}}]=4.0\times {{10}^{-16}}$、${{K}_{\rm sp}}\rm [Co{{(OH)}_{2}}]=1.6\times {{10}^{-15}}$、${{K}_{\rm sp}}\rm [Mn{{(OH)}_{2}}]=1.0\times {{10}^{-13}}$,其中$\rm NiOH{{)}_{2}}$的${{K}_{\rm sp}}$最小最先生成沉淀,故为防止生成氢氧化物,只需计算$\rm NiOH{{)}_{2}}$刚开始沉淀的$\rm pH$即可,$\rm 0.10\ {mol} \cdot {L}^{-1}$,$\rm pH=14-7.2=6.8$;
前驱体$\rm N{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}C{{O}_{3}}$与$\rm L{{i}_{2}}C{{O}_{3}}$在空气中烧结反应的化学方程式为 。
$\\rm 4N{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}C{{O}_{3}}+2L{{i}_{2}}C{{O}_{3}}+{{O}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}4\\ LiN{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}{{O}_{2}}+6C{{O}_{2}}$
"]]放电后正极物质为$\rm LiN{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}{{O}_{2}}$,故前驱体$\rm N{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}C{{O}_{3}}$与$\rm L{{i}_{2}}C{{O}_{3}}$在空气中烧结反应的化学方程式为$\rm 4N{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}C{{O}_{3}}+2L{{i}_{2}}C{{O}_{3}}+{{O}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}4\ LiN{{i}_{0.6}}C{{o}_{0.2}}M{{n}_{0.2}}{{O}_{2}}+6C{{O}_{2}}$;
烧结前为确定前驱体中$\rm Ni$、$\rm Co$、$\rm Mn$的物质的量之比,其中锰元素含量测定方法如下:取$m$ $\rm g$前驱体,酸溶后中和剩余酸,再加入足量$\rm N{{a}_{2}}{{S}_{2}}{{O}_{8}}$溶液,充分反应,过滤得到$\rm Mn{{O}_{2}}$沉淀,洗涤沉淀,再加入还原剂,待$\rm Mn{{O}_{2}}$完全溶解,将溶液体积定容至$\rm 100$ $\rm mL$,取$\rm 20.00$ $\rm mL$稀释液,加入指示剂,以$c\ \rm mol\cdot {{L}^{-1}}$标准$\rm EDTA({{H}_{2}}{{Y}^{2-}})$溶液滴定,消耗标准溶液$V$ $\rm mL$。(已知$\rm EDTA$与$\rm M{{n}^{2+}}$反应为$\rm M{{n}^{2+}}+{{H}_{2}}{{Y}^{2-}}=Mn{{Y}^{2-}}+2{{H}^{+}}$)
样品中$\rm Mn$的质量分数为 (用含$m$、$c$和$V$的代数式表示)。
$0.275cV/m$
"]]已知$\rm EDTA$与$\rm M{{n}^{2+}}$反应为$\rm M{{n}^{2+}}+{{H}_{2}}{{Y}^{2-}}=Mn{{Y}^{2-}}+2{{H}^{+}}$,将溶液体积定容至$\rm 100$ $\rm mL$,只取了$\rm 20.00$ $\rm mL$稀释液,则样品中$\rm Mn$的质量分数为$\dfrac{cV\times {{10}^{-3}}\times \dfrac{100}{20}\ \rm mol\times 55\ g/mol}{m}\times 100\%=\dfrac{0.275cV}{m}\times 100\%$;
近日中国科学技术大学陈维课题组首次提出了一种基于电化学原理的绿色可持续方案,能够同时实现废旧锂离子电池的锂资源回收、工业尾气中的$\rm N{{O}_{2}}$的捕获和转化、同时获得电能,其原理如下图所示,图中应选用 (“阳离子”“阴离子”“质子”)交换膜,左侧电极反应式为 。
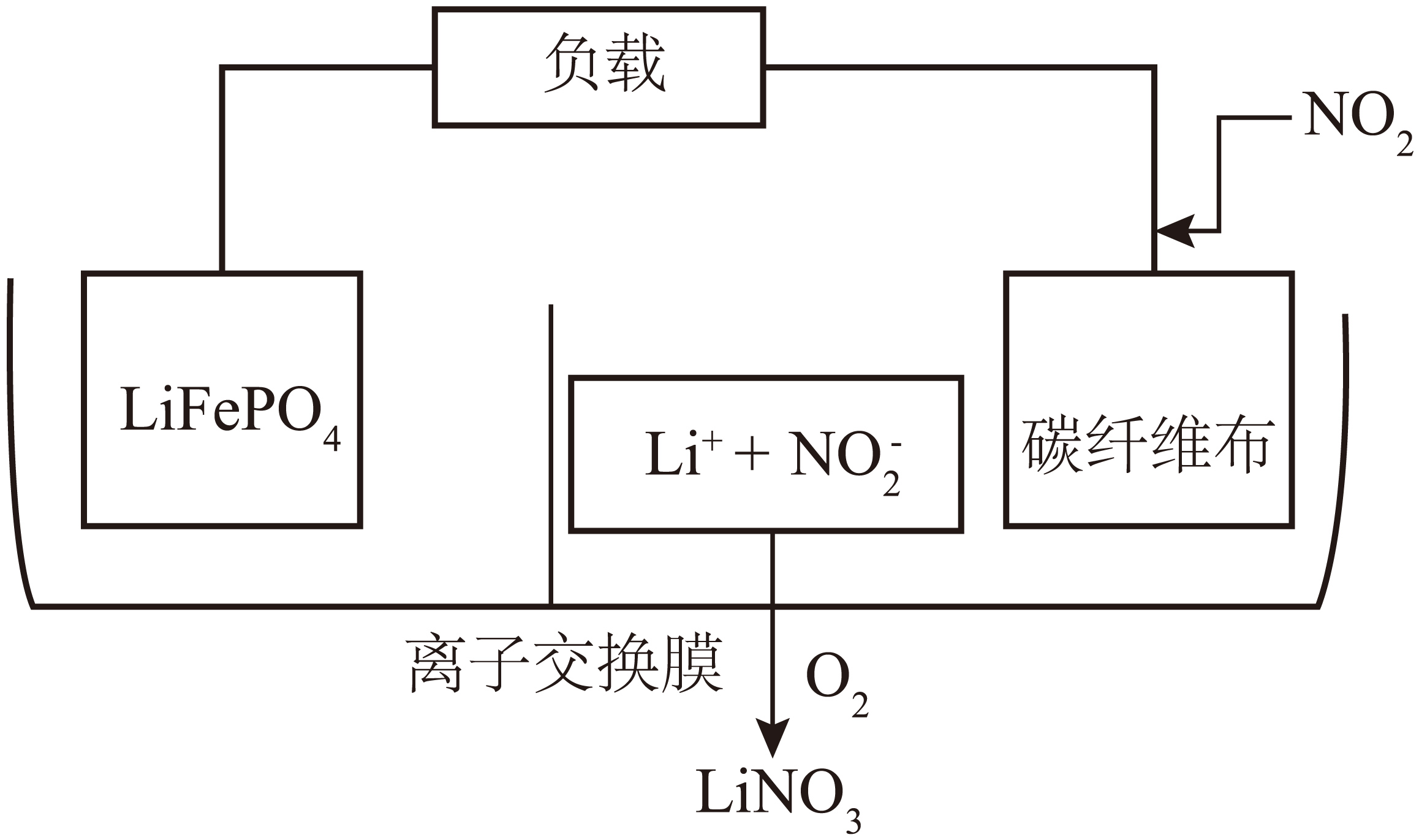
阳离子 ;$\\rm LiFeP{{O}_{4}}-{{e}^{-}}=L{{i}^{+}}+FeP{{O}_{4}}$
"]]捕获$\rm N{{O}_{2}}$的转化为亚硝酸根,故右侧为原电池正极,阳离子锂离子移向正极实现废旧锂离子电池的锂资源回收,图中应选用阳离子交换膜;
左侧为原电池负极,电极反应式为$\rm LiFeP{{O}_{4}}-{{e}^{-}}=L{{i}^{+}}+FeP{{O}_{4}}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
