高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
利用水钴矿$\rm ($主要成分为$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$,含少量$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$、$\text{MnO}$、$\text{MgO}$、$\text{CaO}$、$\text{Si}{{\text{O}}_{2}}$等$\rm )$可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程。
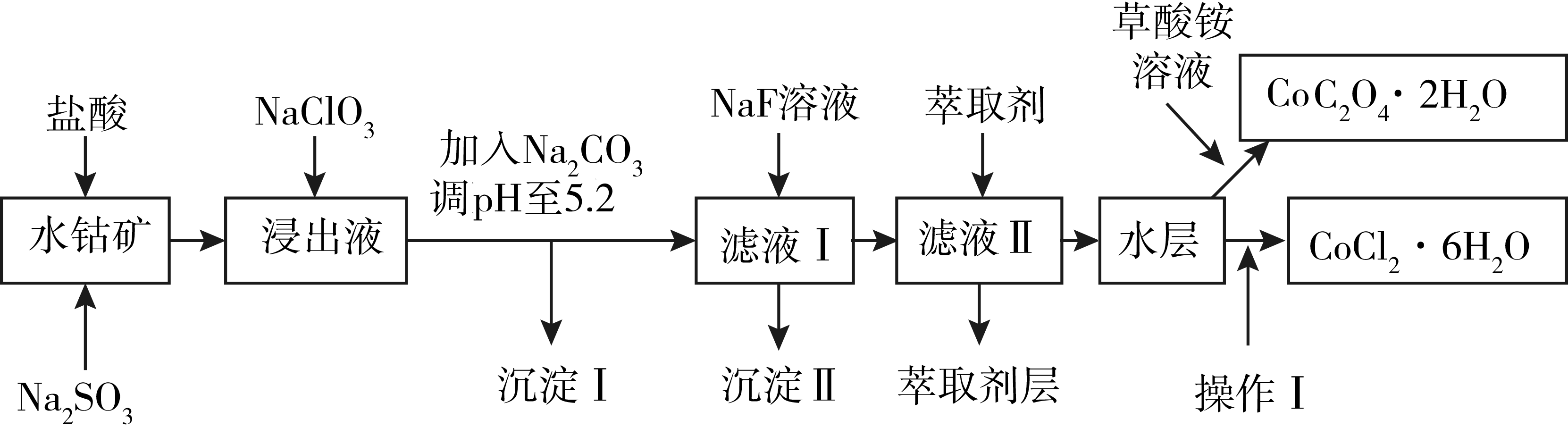
已知:①常温下。流程中部分阳离子以氢氧化物形式沉淀时溶液的$\text{pH}$如表所示:
沉淀物 | $\text{Fe}{{\left( \text{OH} \right)}_{3}}$ | $\text{Fe}{{\left( \text{OH} \right)}_{2}}$ | $\text{Co}{{\left( \text{OH} \right)}_{2}}$ | $\text{Al}{{\left( \text{OH} \right)}_{3}}$ | $\text{Mn}{{\left( \text{OH} \right)}_{2}}$ |
开始沉淀 | $2.7$ | $7.6$ | $7.6$ | $4.0$ | $7.7$ |
完全沉淀 | $3.7$ | $9.6$ | $9.2$ | $5.2$ | $9.8.$ |
②$\text{Ca}{{\text{F}}_{2}}$、$\text{Mg}{{\text{F}}_{2}}$均难溶于水。
写出盐酸酸浸水钴矿过程中发生的主要反应的离子方程式 。
$\\text{C}{{\\text{o}}_{\\text{2}}}{{\\text{O}}_{3}}+\\text{SO}_{3}^{2-}+4{{\\text{H}}^{+}}=2\\text{C}{{\\text{o}}^{2+}}+\\text{SO}_{4}^{2-}+2{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]水钴矿主要成分$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$,加入$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$和盐酸,$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$具有氧化性,$\text{SO}_{3}^{2-}$具有还原性,$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$将$\text{SO}_{3}^{2-}$氧化为$\text{SO}_{4}^{2-}$,自身被还原为$\text{C}{{\text{o}}^{2+}}$,根据得失电子守恒、电荷守恒和原子守恒配平得到该离子方程式$\text{C}{{\text{o}}_{\text{2}}}{{\text{O}}_{3}}+\text{SO}_{3}^{2-}+4{{\text{H}}^{+}}=2\text{C}{{\text{o}}^{2+}}+\text{SO}_{4}^{2-}+2{{\text{H}}_{\text{2}}}\text{O}$。
结合以上制备流程,推测在此反应条件下,$\text{ClO}_{3}^{-}$、$\text{C}{{\text{o}}^{3+}}$、$\text{F}{{\text{e}}^{3+}}$的氧化性从强到弱的顺序 。
$\\text{C}{{\\text{o}}^{3+}}\\gt \\text{ClO}_{3}^{-}\\gt \\text{F}{{\\text{e}}^{3+}}$
"]]浸出液中含$\rm Co^{2+}$、$\rm Fe^{2+}$、$\rm Al^{3+}$、$\rm Mn^{2+}$、$\rm Mg^{2+}$、$\rm Ca^{2+}$,加入$\text{NaCl}{{\text{O}}_{3}}$,$\text{NaCl}{{\text{O}}_{3}}$能将$\text{F}{{\text{e}}^{2+}}$氧化为$\text{F}{{\text{e}}^{3+}}$,但不能将$\text{C}{{\text{o}}^{2+}}$氧化成$\text{C}{{\text{o}}^{3+}}$,所以氧化性顺序为$\text{C}{{\text{o}}^{3+}}\gt \text{ClO}_{3}^{-}\gt \text{F}{{\text{e}}^{3+}}$。
已知氧化性$\text{Mn}{{\text{O}}_{2}}\gt \rm ClO_{3}^{-}$,则沉淀$\rm I$的主要成分是 ,萃取剂层所含金属元素只有锰元素,则萃取后的水层包含的金属阳离子有 。
$\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}$、$\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}$ ; $\\text{C}{{\\text{o}}^{2+}}$、$\\text{N}{{\\text{a}}^{+}}$
"]]加入$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{3}}$调$\text{pH}$至$\rm 5.2$ ,根据阳离子以氢氧化物形式沉淀的$\text{pH}$数据,$\text{F}{{\text{e}}^{3+}}$在$\text{pH}\rm =3.7$完全沉淀,$\text{A}{{\text{l}}^{3+}}$在$\text{pH}\rm =5.2$完全沉淀,所以沉淀Ⅰ主要成分是$\text{Fe}{{\left( \text{OH} \right)}_{3}}$、$\text{Al}{{\left( \text{OH} \right)}_{3}}$ 。加入$\text{NaF}$溶液沉淀$\text{C}{{\text{a}}^{2+}}$、$\text{M}{{\text{g}}^{2+}}$,萃取剂层只有锰元素,说明锰被萃取除去,那么萃取后的水层包含的金属阳离子有$\text{C}{{\text{o}}^{2+}}$、$\rm Na^{+}$。
得到氯化钴晶体的操作$\rm I$主要包括:向水层中加入 调整$\text{pH}$至$2\sim 3$, 、过滤、洗涤、减压烘干等过程。
盐酸 ; 蒸发浓缩、冷却结晶
"]]为抑制$\text{C}{{\text{o}}^{2+}}$水解,向水层中加盐酸调$\text{pH}$至$\rm 2$ ~ $\rm 3$ ,从溶液中得到$\text{CoC}{{\text{l}}_{2}}\cdot 6{{\text{H}}_{\text{2}}}\text{O}$晶体,需经过蒸发浓缩、冷却结晶、过滤、洗涤、减压烘干等过程 。
根据表格中的数据计算,若某溶液中同时存在$\text{Fe}{{\left( \text{OH} \right)}_{2}}$和$\text{Co}{{\left( \text{OH} \right)}_{2}}$两种沉淀,则此溶液中$\text{F}{{\text{e}}^{2+}}$和$\text{C}{{\text{o}}^{2+}}$的浓度比值的数量级是 。
${{10}^{0}}$
"]]$\text{Fe}{{\left( \text{OH} \right)}_{2}}$完全沉淀$\rm =9.6$,$c\text{(O}{{\text{H}}^{-}}\text{)}={{10}^{-4.4}}\;\rm \text{mol}/\text{L}$,${{K}_{\text{sp}}}[\!\!\text{ Fe(OH}{{\text{)}}_{\text{2}}}]=c(\text{F}{{\text{e}}^{2+}}\text{)}{{c}^{2}}\text{(O}{{\text{H}}^{-}}\text{)}={{10}^{-13.8}}$;$\text{Co}{{\left( \text{OH} \right)}_{2}}$完全沉淀$\text{pH}\rm =9.2$,$c\text{(O}{{\text{H}}^{-}}\text{)}={{10}^{-4.8}}\;\rm \text{mol}/\text{L}$,${{K}_{\text{sp}}}\left[ \text{Co(OH}{{\text{)}}_{2}} \right]=c(\text{C}{{\text{o}}^{2+}}\text{)}{{c}^{2}}\text{(O}{{\text{H}}^{-}}\text{)}={{10}^{-14.6}}$。两种沉淀共存时,$\dfrac{c\text{(F}{{\text{e}}^{2+}}\text{)}}{c\text{(C}{{\text{o}}^{2+}}\text{)}}=\dfrac{{{K}_{\text{sp}}}[\!\!\text{ Fe(OH}{{)}_{2}}]}{{{K}_{\text{sp}}}[\!\!\text{ Co(OH}{{)}_{2}}]}=\dfrac{{{10}^{-13.8}}}{{{10}^{-14.6}}}={{10}^{0.8}}$,数量级为${{10}^{0}}$。
取一定质量的二水合草酸钴产品,在空气中加热令其分解,得到钴氧化物$\rm ($其中钴的价态为$+2+3)$,用$1.0\,\text{L}\,1\;\rm \text{mol}/\text{L}$的盐酸溶液恰好将此钴氧化物完全溶解,得到$\text{CoC}{{\text{l}}_{2}}$溶液和标准状况下$\rm 2.24$ $\rm L$黄绿色气体,则此钴氧化物的摩尔质量为 。
$316\\,\\text{g}/\\text{mol}$
"]]标准状况下$\rm 2.24$ $\rm L$氯气物质的量为$\rm 0.1$ $\rm mol$,$\rm 1.0$ $\rm L$ $\rm 1$ $\rm mol/L$盐酸中$\rm HCl$物质的量为$\rm 1$ $\rm mol$ 。设钴氧化物化学式为$\text{C}{{\text{o}}_{x}}{{\text{O}}_{y}}$,根据$\text{C}{{\text{o}}_{x}}{{\text{O}}_{y}}+\text{HCl}\to \text{CoC}{{\text{l}}_{2}}+\text{C}{{\text{l}}_{2}}\uparrow +{{\text{H}}_{\text{2}}}\text{O}$,由氯元素守恒可知生成$\text{CoC}{{\text{l}}_{2}}$中$\rm Cl$元素物质的量为$1\,\text{mol}-0.1\,\text{mol}\times 2=0.8\,\text{mol}$,则$\text{CoC}{{\text{l}}_{2}}$物质的量为$\rm 0.4$ $\rm mol$ 。根据电子守恒,$n\text{(C}{{\text{o}}^{3+}})=2n(\text{C}{{\text{l}}_{\text{2}}})=0.2\,\text{mol}$,$n\text{(C}{{\text{o}}^{2+}})=0.4\,\text{mol}-0.2\,\text{mol}=0.2\,\text{mol}$。根据电荷守恒,$2n\left( {{\text{O}}^{2-}} \right)=0.2\,\text{mol}\times 2+0.2\,\text{mol}\times 3$,解得$n\left( {{\text{O}}^{\text{2-}}} \right)=0.5\,\text{mol}$,则$x:y=0.4\,\text{mol}:0.5\,\text{mol}=4:5$,则$\text{C}{{\text{o}}_{x}}{{\text{O}}_{y}}$为$\text{C}{{\text{o}}_{\text{4}}}{{\text{O}}_{\text{5}}}$,摩尔质量为$\text{(4}\times \text{59+5}\times \text{16)}\,\text{g}/\text{mol}=316\,\text{g}/\text{mol}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
