高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\rm {{A}_{2}}B$型二元储氢合金由容易形成稳定氢化物的金属作为$\rm A$,难于形成氢化物但具有催化活性的金属作为$\rm B$,典型代表是$\rm M{{g}_{2}}Ni$合金。$\rm M{{g}_{2}}Ni$在一定条件下能与氢气生成$\rm M{{g}_{2}}Ni{{H}_{4}}$,高温$\rm M{{g}_{2}}Ni{{H}_{4}}$的晶胞如图所示,该立方晶胞参数为$a$ $\rm pm$。(已知:$\rm 储氢能力=\dfrac{材料中氢的密度}{液氢密度}$,液氢密度为$d\ \rm g\cdot c{{m}^{-3}}$,${{N}_{\rm A}}$为阿伏加德罗常数的值)
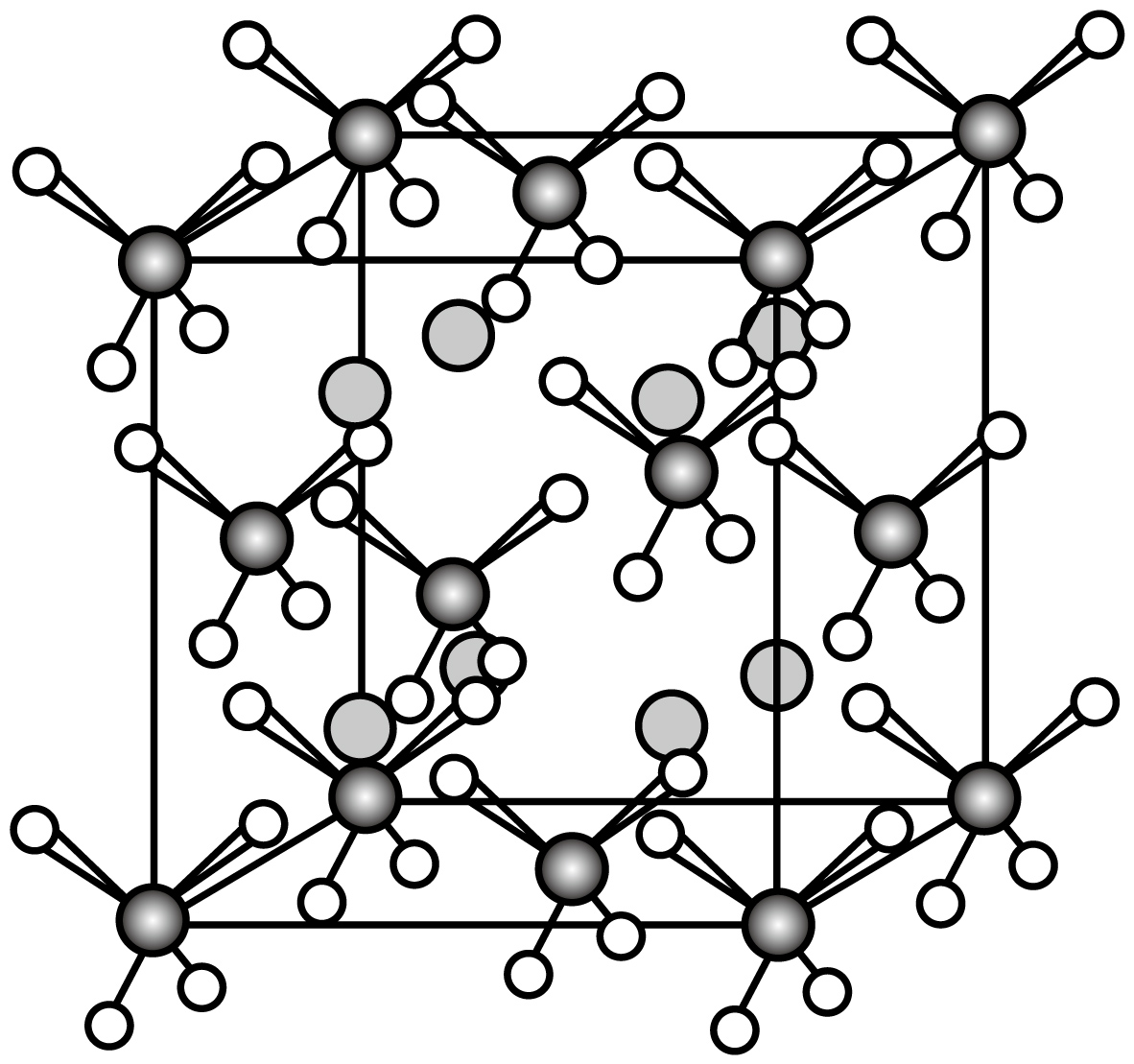
下列说法错误的是$\rm (\qquad)$
$\\rm 1$个$\\rm M{{g}_{2}}Ni{{H}_{4}}$晶胞含有$\\rm 16$个$\\rm H$
","$\\rm 2$个镁离子间最近距离为$\\dfrac{\\sqrt{2}}{2}a\\ \\rm pm$
","$\\rm M{{g}_{2}}Ni{{H}_{4}}$的储氢能力为$\\dfrac{16\\times {{10}^{30}}}{{{a}^{3}}d{{N}_{\\rm A}}}$
","$\\rm M{{g}_{2}}Ni{{H}_{4}}$与水反应的化学反应方程式:$\\rm M{{g}_{2}}Ni{{H}_{4}}+4{{H}_{2}}O=2Mg{{(OH)}_{2}}+Ni+4{{H}_{2}}\\uparrow $
"]$\rm A$.$\rm M{{g}_{2}}Ni{{H}_{4}}$晶胞中含有$\rm 8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$个$\rm M{{g}_{2}}Ni{{H}_{4}}$,故含有$\rm 16$个$\rm H$,$\rm A$正确;
$\rm B$.将$\rm M{{g}_{2}}Ni{{H}_{4}}$晶胞均分为$\rm 8$个小正方体,镁分别位于$\rm 8$个小正方体的体心,镁之间的最短距离为$\dfrac{1}{2}a$,$\rm B$错误;
$\rm C$.$\rm M{{g}_{2}}Ni{{H}_{4}}$晶胞中含有$\rm 8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$个$\rm M{{g}_{2}}Ni{{H}_{4}}$,故含有$\rm 8$个镁,$\rm 4$个镍和$\rm 16$个氢,该晶胞中氢气体积分数为$\rm \dfrac{16}{24\times 8+59\times 4+16}=\dfrac{4}{111}$,晶胞密度为$\dfrac{444}{{{a}^{3}}\times {{10}^{-30}}\times {{N}_{\rm A}}}$,$储氢能力=\dfrac{晶体密度\times 氢气质量分数}{液氢密度}=\dfrac{\dfrac{444}{{{a}^{3}}\times {{10}^{-30}}\times {{N}_{\rm A}}}\times \dfrac{4}{111}}{d}=\dfrac{16\times {{10}^{30}}}{{{a}^{3}}\times d\times {{N}_{\rm A}}}$,$\rm C$正确;
$\rm D$.$\rm M{{g}_{2}}Ni{{H}_{4}}$与水反应能生成氢气,化学反应方程式为$\rm M{{g}_{2}}Ni{{H}_{4}}+4{{H}_{2}}O=2Mg(OH{{)}_{2}}+Ni+4{{H}_{2}}\uparrow $,$\rm D$正确;
故选:B
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
