高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
文物出水清淤后,须尽快浸泡在稀$\text{NaOH}$或$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$溶液中进行现场保护。
①玻璃中的$\text{Si}{{\text{O}}_{\text{2}}}$能与$\text{NaOH}$反应生成 $\rm ($填化学式$\rm )$,故不能使用带磨口玻璃塞的试剂瓶盛放$\text{NaOH}$溶液。
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有 。
$\\text{N}{{\\text{a}}_{2}}\\text{Si}{{\\text{O}}_{3}}$ ; 碱性环境抑制吸氧腐蚀正极反应的进行,反应速率减慢;碱性溶液中,${{\\text{O}}_{2}}$溶解度较小,减少文物与${{\\text{O}}_{2}}$的接触,减缓吸氧腐蚀
"]]①$\text{Si}{{\text{O}}_{2}}$是酸性氧化物,可与$\rm NaOH$溶液发生反应生成硅酸钠和水,化学方程式为$\text{Si}{{\text{O}}_{2}}+2\text{NaOH}=\text{N}{{\text{a}}_{2}}\text{Si}{{\text{O}}_{3}}+{{\text{H}}_{2}}\text{O}$。
②吸氧腐蚀时正极反应式为${{\text{O}}_{2}}+4{{\text{e}}^{-}}+2{{\text{H}}_{2}}\text{O}=4\text{O}{{\text{H}}^{-}}$,根据化学平衡移动原理,碱性溶液中,$\text{O}{{\text{H}}^{-}}$浓度较大,会抑制${{\text{O}}_{2}}$得电子,使吸氧腐蚀的速率减慢;${{\text{O}}_{2}}$在高离子浓度的液体中溶解度较小,碱性溶液比纯水溶解氧的能力低,减少了文物与${{\text{O}}_{2}}$的接触,减缓吸氧腐蚀。
文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的$\text{Fe}$与海水中的$\text{SO}_{4}^{2-}$在细菌作用下形成$\text{FeS}$等含铁凝结物。写出$\text{Fe}$与$\text{SO}_{4}^{2-}$反应生成$\text{FeS}$和$\text{Fe}{{(\text{OH})}_{2}}$的离子方程式: 。
②有氧环境中,海水中的铁质文物表面形成$\text{FeOOH}$等凝结物。
$\rm (i)$铁在盐水中腐蚀的可能原理如图所示。依据原理设计如下实验:向$\text{NaCl}$溶液中加入${{\text{K}}_{3}}\left[ \text{Fe}{{(\text{CN})}_{6}} \right]$溶液$\rm ($能与$\text{F}{{\text{e}}^{2+}}$形成蓝色沉淀$\rm )$和酚酞,将混合液滴到生铁片上。预测该实验的现象为 。
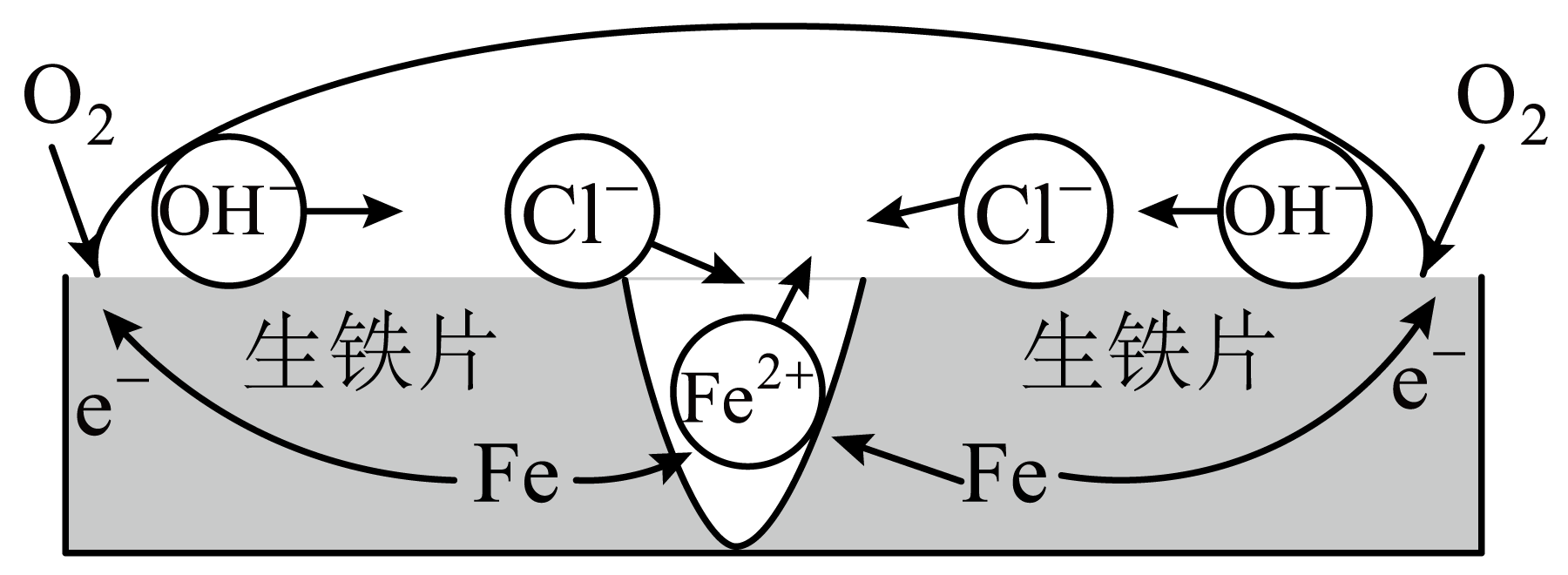
$\rm (ii)$铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集$\text{C}{{\text{l}}^{-}}$的可能原因。该胶粒的形成过程中,参与的主要阳离子有 $\rm ($填离子符号$\rm )$。
$4\\text{Fe}+\\text{SO}_{4}^{2-}+4{{\\text{H}}_{2}}\\text{O}\\begin{matrix} \\underline{\\underline{细菌}} \\\\ {} \\\\\\end{matrix}\\text{FeS}+3\\text{Fe}{{(\\text{OH})}_{2}}+2\\text{O}{{\\text{H}}^{-}}$ ; 滴加混合溶液后,铁片表面将出现蓝色和红色区域,较长时间后出现黄色斑点 ; $\\text{F}{{\\text{e}}^{3+}}$、$\\text{F}{{\\text{e}}^{2+}}$
"]]①无氧、弱碱性的海水中,$\rm Fe$在细菌作用下,被$\text{SO}_{4}^{2-}$氧化为$+2$价的$\rm FeS$、$\text{Fe}{{\left( \text{OH} \right)}_{2}}$,根据得失电子守恒、电荷守恒、原子守恒可写出该反应的离子方程式:$4\text{Fe}+\text{SO}_{4}^{2-}+4{{\text{H}}_{2}}\text{O}\begin{matrix} \underline{\underline{细菌}} \\ {} \\\end{matrix}\text{FeS}+3\text{Fe}{{(\text{OH})}_{2}}+2\text{O}{{\text{H}}^{-}}$。
②$\rm ($ⅰ$\rm )$由题图知,铁片在$\rm NaCl$溶液中发生吸氧腐蚀,开始时,负极反应式为$\mathrm{Fe}-2 \mathrm{e}^{-}=\mathrm{Fe}^{2+}$,正极反应式为${{\text{O}}_{2}}+4{{\text{e}}^{-}}+2{{\text{H}}_{2}}\text{O}=4\text{O}{{\text{H}}^{-}}$。$\text{F}{{\text{e}}^{2+}}$与${{\text{K}}_{3}}\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]$反应生成$\text{KFe}\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]$蓝色沉淀,即铁片上会出现蓝色区域;溶液中酚酞遇到$\text{O}{{\text{H}}^{-}}$变红,铁片上会出现红色区域;由“有氧环境中,海水中的铁质文物表面形成$\rm FeOOH$”知,$\text{F}{{\text{e}}^{2+}}$在盐水中被${{\text{O}}_{2}}$氧化成黄色的$\rm FeOOH$,故现象是滴加混合溶液后,铁片表面将出现蓝色和红色区域,较长时间后出现黄色斑点;
$\rm ($ⅱ$\rm )$铁片发生吸氧腐蚀,负极区生成$\text{F}{{\text{e}}^{2+}}$,被${{\text{O}}_{2}}$进一步氧化为$\text{F}{{\text{e}}^{3+}}$,此时体系中的阳离子主要有 $\text{F}{{\text{e}}^{3+}}$、$\text{F}{{\text{e}}^{2+}}$
。
为比较含氯$\text{FeOOH}$在$\text{NaOH}$溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯$\text{FeOOH}$模拟样品,将其分为两等份, ,比较滴加$\text{AgN}{{\text{O}}_{3}}$溶液体积$ [{{K}_{\text{sp}}}(\text{AgCl})=1.8\times {{10}^{-10}}$。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、$0.5\,\text{mol}\cdot {{\text{L}}^{-1}}\,\text{NaOH}$溶液、$0.5\,\text{mol}\cdot {{\text{L}}^{-1}}\,\text{HN}{{\text{O}}_{3}}$溶液、$0.05\,\text{mol}\cdot {{\text{L}}^{-1}}\,\text{AgN}{{\text{O}}_{3}}$溶液$\rm ]$。
分别加入等体积$\\rm ($如$\\rm 5$ $\\rm mL)$的$0.5\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}\\,\\text{NaOH}$溶液和蒸馏水至浸没样品,在室温下,搅拌、浸泡$\\rm 30$ $\\rm min$;过滤,各取等量上清液$\\rm ($如$\\rm 2$ $\\rm mL)$置于两支小试管中,分别滴加$3\\,\\text{mL}\\,0.5\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}\\,\\text{HN}{{\\text{O}}_{3}}$溶液酸化,再分别滴加$0.05\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}\\,\\text{AgN}{{\\text{O}}_{3}}$溶液;记录每份上清液至出现$\\rm AgCl$白色沉淀时消耗的$\\text{AgN}{{\\text{O}}_{3}}$溶液体积
"]]要检验脱氯效果,应控制样品用量、脱氯时间、取用体积等变量相同,利用$\text{A}{{\text{g}}^{+}}$与$\text{C}{{\text{l}}^{-}}$的反应进行实验。实验中,首先需要将等量的含氯$\rm FeOOH$模拟样品分别用等体积的$\rm NaOH$溶液与蒸馏水浸泡脱氯,然后过滤,得到上清液,取等体积的两种上清液,先用$\text{HN}{{\text{O}}_{3}}$溶液酸化,再加入$\text{AgN}{{\text{O}}_{3}}$溶液,通过比较出现$\rm AgCl$白色沉淀时消耗。$\text{AgN}{{\text{O}}_{3}}$溶液体积的大小,即可比较脱氯效果。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
