高中 | 原子的基态与激发态、光谱 题目答案及解析
稿件来源:高途
高中 | 原子的基态与激发态、光谱题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
原子的基态与激发态、光谱
绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了$\text{Cr}-\text{Fe}-\text{Al}-\text{Mg}$的深度利用和$\text{N}{{\text{a}}^{+}}$内循环。工艺流程如下:
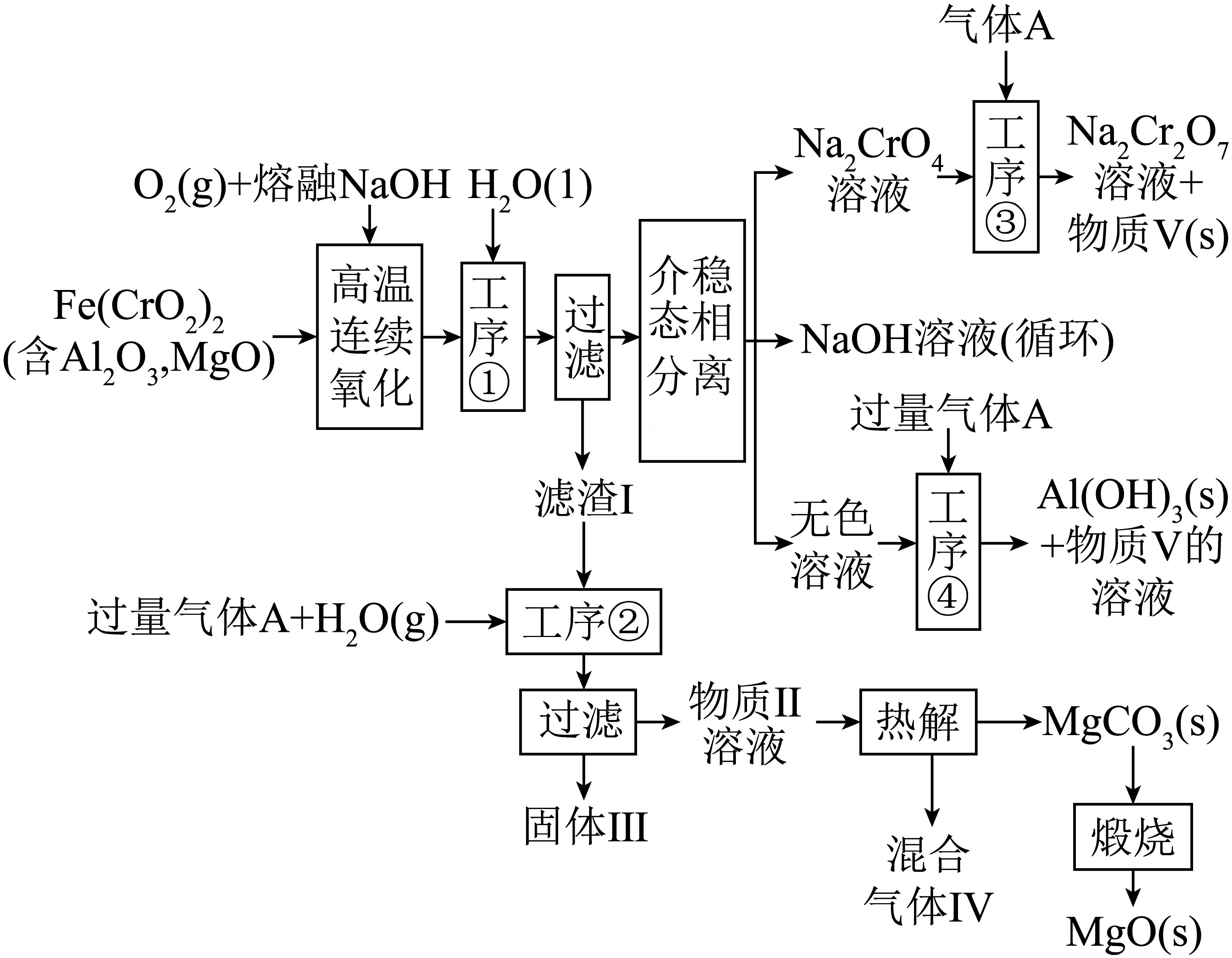
回答下列问题:
基态铬在周期表中位置为 ;钠在火焰上灼烧产生的黄光是一种 $\rm ($填“吸收光谱”或“发射光谱”$\rm )$。
第四周期第Ⅵ$\\rm B$族 ; 发射光谱
"]]基态铬$\rm (Cr)$原子序数为$\rm 24$,电子排布式为$[\!\!\text{ Ar }\!\!]\!\!\text{ 3}{{\text{d}}^{\text{5}}}\text{4}{{\text{s}}^{1}}$,在周期表中位于第四周期Ⅵ$\rm B$族;钠在火焰上灼烧产生黄光是电子跃迁释放能量,属于发射光谱。
工序“高温连续氧化”中发生的氧化还原反应化学方程式是 。
$4\\text{Fe}{{\\left( \\text{Cr}{{\\text{O}}_{2}} \\right)}_{2}}+16\\text{NaOH}+7{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\\\end{matrix}\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}+8\\text{N}{{\\text{a}}_{2}}\\text{Cr}{{\\text{O}}_{4}}+8{{\\text{H}}_{2}}\\text{O}$
"]]由工艺可知,“高温连续氧化”是$\text{Fe}{{(\text{Cr}{{\text{O}}_{\text{2}}})}_{2}}$与${{\text{O}}_{\text{2}}}$、$\text{NaOH}$反应,生成$\text{N}{{\text{a}}_{\text{2}}}\text{Cr}{{\text{O}}_{4}}$、$\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$等,结合守恒得反应方程式:$4\text{Fe}{{\left( \text{Cr}{{\text{O}}_{2}} \right)}_{2}}+16\text{NaOH}+7{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\\end{matrix}\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}+8\text{N}{{\text{a}}_{2}}\text{Cr}{{\text{O}}_{4}}+8{{\text{H}}_{2}}\text{O}$ 。
固体Ⅲ的主要成分是 $\rm ($填化学式$\rm )$。
$\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}$
"]]分析流程,工序②中加入过量气体$\rm A(\text{C}{{\text{O}}_{2}}\rm )$和水,$\text{AlO}_{\text{2}}^{-}$转化为$\text{Al}{{\left( \text{OH} \right)}_{\text{3}}}$沉淀,$\text{MgO}$不反应,过滤后固体Ⅲ主要成分是$\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{3}}$ 。
“高温连续氧化”工序可选择流程中产物 代替熔融$\text{NaOH}\rm ($写化学式$\rm )$。
$\\text{NaHC}{{\\text{O}}_{3}}$
"]]流程中“工序④”生成物质$\rm V$ 溶液$\rm ($循环$\rm )$,可代替熔融$\text{NaOH}$,化学式为$\text{NaHC}{{\text{O}}_{\text{3}}}$。
“工序③”中通入 $\rm ($填“足量”或“少量”$\rm )$的气体$\text{A}$更有利于得到重铬酸盐。
足量
"]]“工序③”中,气体$\rm A$若为$\text{C}{{\text{O}}_{2}}$,通入足量$\text{C}{{\text{O}}_{2}}$ ,可使$\text{N}{{\text{a}}_{\text{2}}}\text{Cr}{{\text{O}}_{\text{4}}}$转化更充分,有利于得到重铬酸盐。
“工序④”中发生反应的离子方程式为 。
$\\text{AlO}_{2}^{-}+\\text{C}{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}=\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +\\text{HCO}_{3}^{-} $或${{\\left[ \\text{Al}{{\\left( \\text{OH} \\right)}_{4}} \\right]}^{-}}+\\text{C}{{\\text{O}}_{2}}=\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +\\text{HCO}_{3}^{-}$
"]]“工序④”是$\text{AlO}_{\text{2}}^{-}$与足量$\text{C}{{\text{O}}_{\text{2}}}$、${{\text{H}}_{\text{2}}}\text{O}$反应生成$\text{Al}{{\left( \text{OH} \right)}_{\text{3}}}$沉淀,离子方程式:$\text{AlO}_{2}^{-}+\text{C}{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=\text{Al}{{\left( \text{OH} \right)}_{3}}\downarrow +\text{HCO}_{3}^{-}$。
欲使$0.01\text{ mol}\cdot {{\text{L}}^{-1}}$的$\text{N}{{\text{a}}_{2}}\text{Cr}{{\text{O}}_{4}}$溶液中的$\text{CrO}_{4}^{2-}$沉淀完全$\rm ($离子浓度$\le 1\times {{10}^{-5}}\text{ mol}\cdot {{\text{L}}^{-1}}\rm )$。需加入等体积且浓度至少为 $\mathrm{mol} \cdot \mathrm{L}^{-1}$的$\text{AgN}{{\text{O}}_{3}}$溶液。$\rm ($已知$\text{A}{{\text{g}}_{2}}\text{Cr}{{\text{O}}_{4}}$难溶于水,常温时${{K}_{\text{sp}}}=1\times {{10}^{-11}}\rm )$
$2.2\\times {{10}^{-2}}\\rm ($或$\\rm 0.022)$
"]]${{K}_{\text{sp}}}\text{(A}{{\text{g}}_{\text{2}}}\text{Cr}{{\text{O}}_{\text{4}}})={{c}^{\text{2}}}\text{(A}{{\text{g}}^{+}})\cdot c\text{(CrO}_{\text{4}}^{\text{2-}}\text{)}=1\times {{10}^{-11}}$,$\text{CrO}_{\text{4}}^{\text{2-}}$沉淀完全时$c\text{(CrO}_{\text{4}}^{\text{2-}}\text{)}\le 1\times {{10}^{-5}}\ \text{mol}\cdot {{\text{L}}^{-1}}$,则$c\text{(A}{{\text{g}}^{+}})=\sqrt{\dfrac{{{K}_{\text{sp}}}}{c\text{(CrO}_{\text{4}}^{\text{2-}}\text{)}}}=\sqrt{\dfrac{1\times {{10}^{-11}}}{1\times {{10}^{-5}}}}=1\times {{10}^{-3}}\ \text{mol}\cdot {{\text{L}}^{-1}}$。
设$\text{N}{{\text{a}}_{2}}\text{Cr}{{\text{O}}_{4}}$溶液和$\text{AgN}{{\text{O}}_{3}}$溶液体积均为$\rm V$,混合后$c\text{(CrO}_{\text{4}}^{\text{2-}})=\dfrac{0.01V}{2V}=0.005\ \text{ mol}\cdot {{\text{L}}^{-1}}\rm ($沉淀前$\rm )$,沉淀后$c\text{(CrO}_{\text{4}}^{\text{2-}})=1\times {{10}^{-5}}\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}$,根据$n(\text{CrO}_{4}^{2-}):n\text{(A}{{\text{g}}^{+}})=1:2$,消耗$n\text{(A}{{\text{g}}^{+}})=2\times 2\times (0.005-1\times {{10}^{-5}})V\approx 0.02V$,混合后$c\text{(A}{{\text{g}}^{+}}\text{)}=1\times {{10}^{-3}}\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}$,则原$\text{AgN}{{\text{O}}_{3}}$溶液浓度$c=\dfrac{0.02V+1\times {{10}^{-3}}\times 2V}{V}=0.022\ \text{mol}\cdot {{\text{L}}^{-1}}$,计算得原$\text{AgN}{{\text{O}}_{\text{3}}}$浓度至少$0.022\ \text{mol}\cdot {{\text{L}}^{-1}}$。
高中 | 原子的基态与激发态、光谱题目答案及解析(完整版)
