高中 | 原子的基态与激发态、光谱 题目答案及解析
稿件来源:高途
高中 | 原子的基态与激发态、光谱题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
原子的基态与激发态、光谱
氮族元素、氧族元素可以形成许多结构和性质特殊的物质,请回答下列问题:
基态$\rm N$原子核外电子的运动状态有 种:由氮元素形成的三种微粒:①$\rm \left[ He \right]2{{s}^{2}}2{{p}^{3}}$;②$\rm \left[ He \right]2{{s}^{2}}2{{p}^{2}}$;③$\rm \left[ He \right]2{{s}^{2}}2{{p}^{2}}3{{s}^{1}}$。叙述正确的是 。
$\rm A$.微粒半径: ③$\rm \gt $①$\rm \gt $②
$\rm B$.失去一个电子所需最低能量:①$\rm \gt $②$\rm \gt $③
$\rm C$.电子排布属于激发态的是:③
$\rm D$. 得电子能力:①$\rm \gt $②
$\\rm 7$ ;$\\rm AC$
"]]已知$\rm N$为$\rm 7$号元素,核外有$\rm 7$个电子,根据鲍利原理可知,基态$\rm N$原子核外电子的运动状态有$\rm 7$种:由氮元素形成的三种微粒:①$\rm \left[ He \right]2{{s}^{2}}2{{p}^{3}}$即为基态$\rm N$原子;②$\rm \left[ He \right]2{{s}^{2}}2{{p}^{2}}$即为基态$\rm N^{+}$;③$\rm \left[ He \right]2{{s}^{2}}2{{p}^{2}}3{{s}^{1}}$是激发态$\rm N$原子;
$\rm A$.一般电子层数越多原子半径越大,而$\rm N$原子失电子数越多,原子半径越小,则微粒半径:③$\rm \gt $①$\rm \gt $②,$\rm A$正确;
$\rm B$.能量越高越容易失电子,基态原子的第一电离能小于第二电离能,则电离一个电子所需最低能量:②$\rm \gt $①$\rm \gt $③,$\rm B$错误;
$\rm C$.由上述分析可知,原子核外电子排布符合构造原理、能量最低原理的原子属于基态原子或离子,则①基态$\rm N$原子,②为基态$\rm N^{+}$;③是激发态$\rm N$原子,$\rm C$正确;
$\rm D$.能量越低越易得电子,则得电子能力:②$\rm \gt $①,$\rm D$错误;
已知烷基的推电子效应强于$\rm H$原子,$\rm CH_{3}CH_{2}NH_{2}$与$\rm NH_{3}$结合$\rm H^{+}$能力更强的是 $\rm ($填化学式$\rm )$。
$\\rm CH_{3}CH_{2}NH_{2}$
"]]已知烷基的推电子效应强于$\rm H$原子,导致$\rm CH_{3}CH_{2}NH_{2}$中$\rm N$原子周围的电子云密度比$\rm NH_{3}$更大,则$\rm CH_{3}CH_{2}NH_{2}$结合$\rm H^{+}$能力更强;
已知: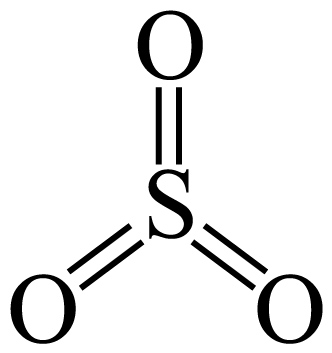 $\rm +H_{2}O\to $
$\rm +H_{2}O\to $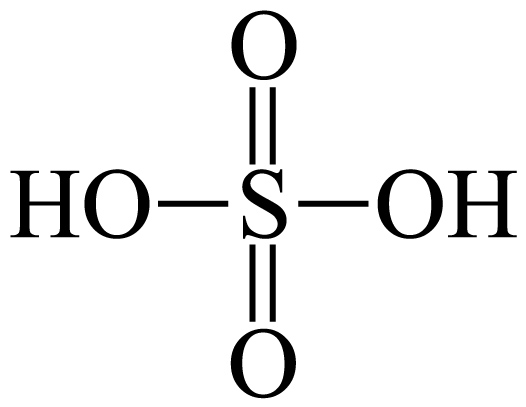 ,类比$\rm SO_{3}$与$\rm CH_{3}OH$反应生成液态酯 $\rm C{{H}_{3}}OS{{O}_{3}}H($一元强酸$\rm )$,其熔沸点 $\rm H_{2}SO_{4}($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,写出该产物与足量$\rm NaOH$溶液在加热条件下反应的离子方程式 。
,类比$\rm SO_{3}$与$\rm CH_{3}OH$反应生成液态酯 $\rm C{{H}_{3}}OS{{O}_{3}}H($一元强酸$\rm )$,其熔沸点 $\rm H_{2}SO_{4}($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,写出该产物与足量$\rm NaOH$溶液在加热条件下反应的离子方程式 。
$\\rm \\lt $ ;$\\rm C{{H}_{3}}OSO_{3}^{-}+H^{+}+2OH^{-}\\begin{matrix} \\underline{\\underline{\\triangle}} \\\\ {} \\\\\\end{matrix}CH_{3}OH+H_{2}O+SO_{4}^{2-}$
"]]根据硫酸的结构简式可推知液态酯$\rm CH_{3}OSO_{3}H$的结构简式为: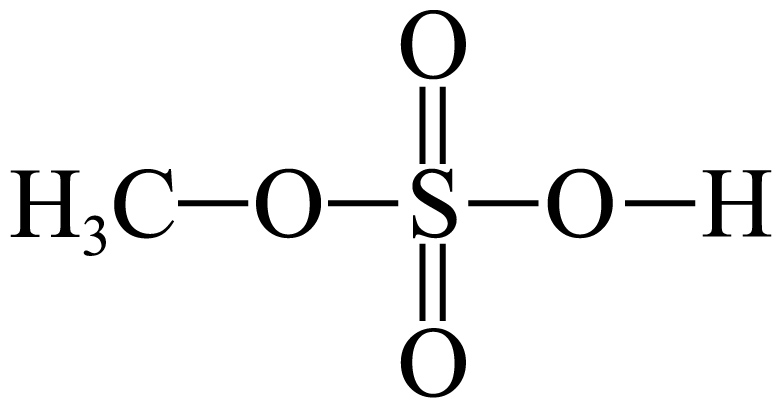 ,故$\rm H_{2}SO_{4}$分子周围形成氢键数目比液态酯$\rm CH_{3}OSO_{3}H$周围形成的氢键多,则其熔沸点$\rm \lt H_{2}SO_{4}$,根据酯的水解反应可知,该产物即$\rm CH_{3}OSO_{3}H$与足量$\rm NaOH$溶液在加热条件下反应的离子方程式为:$\rm C{{H}_{3}}OSO_{3}^{-}+H^{+}+2OH^{-}\begin{matrix} \underline{\underline{\triangle}} \\ {} \\\end{matrix}CH_{3}OH+H_{2}O+SO_{4}^{2-}$;
,故$\rm H_{2}SO_{4}$分子周围形成氢键数目比液态酯$\rm CH_{3}OSO_{3}H$周围形成的氢键多,则其熔沸点$\rm \lt H_{2}SO_{4}$,根据酯的水解反应可知,该产物即$\rm CH_{3}OSO_{3}H$与足量$\rm NaOH$溶液在加热条件下反应的离子方程式为:$\rm C{{H}_{3}}OSO_{3}^{-}+H^{+}+2OH^{-}\begin{matrix} \underline{\underline{\triangle}} \\ {} \\\end{matrix}CH_{3}OH+H_{2}O+SO_{4}^{2-}$;
已知$\rm H_{2}S_{2}O_{3}$的结构式为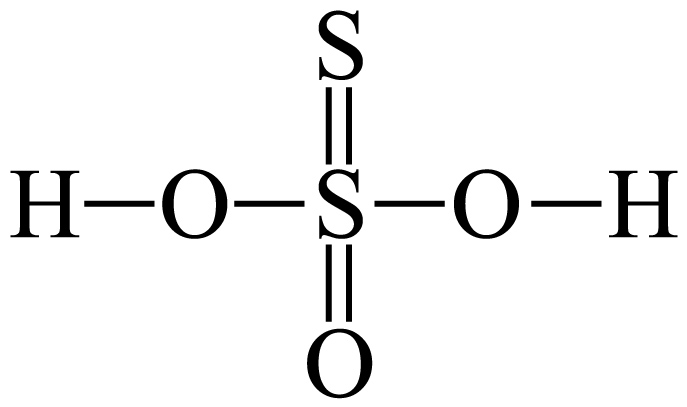 ,推测酸性 $\rm {{H}_{2}}{{S}_{2}}{{O}_{3}}$ $\rm {{H}_{2}}S{{O}_{4}}$ $\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,从结构角度解释原因是 。
,推测酸性 $\rm {{H}_{2}}{{S}_{2}}{{O}_{3}}$ $\rm {{H}_{2}}S{{O}_{4}}$ $\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,从结构角度解释原因是 。
$\\rm \\lt $ ;$\\rm O$的电负性比$\\rm S$的大,导致吸电子能量$\\rm S=S$小于$\\rm S=O$,使得硫代硫酸中羟基极性较小,更难断裂,酸性比硫酸小
"]]已知$\rm H_{2}S_{2}O_{3}$的结构式为 ,由于$\rm O$的电负性比$\rm S$的大,导致吸电子能量$\rm S=S$小于$\rm S=O$,使得硫代硫酸中羟基极性较小,更难断裂,酸性比硫酸小,故可推测酸性 $\rm {{H}_{2}}{{S}_{2}}{{O}_{3}}\lt {{H}_{2}}S{{O}_{4}}$;
,由于$\rm O$的电负性比$\rm S$的大,导致吸电子能量$\rm S=S$小于$\rm S=O$,使得硫代硫酸中羟基极性较小,更难断裂,酸性比硫酸小,故可推测酸性 $\rm {{H}_{2}}{{S}_{2}}{{O}_{3}}\lt {{H}_{2}}S{{O}_{4}}$;
基态 $\rm Se$原子简化电子排布式为 ,下列有关 $\rm Se$的说法正确的是 。
$\rm A$.按照核外电子排布,可把元素周期表划分为$\rm 4$个区,$\rm Se$位于元素周期表$\rm P$区
$\rm B$.与$\rm Se$同周期的元素中含有最多未成对电子的元素是$\rm Cr$
$\rm C$. $\rm Se=O$不稳定,因为其键长较长,$\rm \pi$键重叠较弱
$\rm D$.已知![]() 不能使溴的四氯化碳溶液褪色,推测 $\rm Se$的杂化方式为$\rm sp^{3}$
不能使溴的四氯化碳溶液褪色,推测 $\rm Se$的杂化方式为$\rm sp^{3}$
$\\rm [Ar]3d^{10}4s^{2}4p^{4}$; $\\rm BC$
"]]已知$\rm Se$是$\rm 34$号元素,根据能级构造原理可知,基态$\rm Se$原子简化电子排布式为$\rm [Ar]3d^{10}4s^{2}4p^{4}$,
$\rm A$.按照核外电子排布,可把元素周期表划分为$\rm s$、$\rm p$、$\rm d$、$\rm ds$和$\rm f5$个区,其中$\rm Se$的电子最后进入$\rm p$能级,则$\rm Se$位于元素周期表$\rm P$区,$\rm A$错误;
$\rm B$.由$\rm Se$的原子核外电子排布式可知,$\rm Se$位于第$\rm 4$周期,与$\rm Se$同周期的元素中含有最多未成对电子即$\rm 3d^{5}4s^{1}$有$\rm 6$个未成对电子,该元素是$\rm Cr$,$\rm B$正确;
$\rm C$.一般键长越长键能越小,越不稳定,故$\rm Se=O$不稳定,因为其键长较长,$\rm \pi$键重叠较弱,$\rm C$正确;
$\rm D$.已知![]() 不能使溴的四氯化碳溶液褪色,说明该分子中没有碳碳双键,即存在一个$\rm 5$原子$\rm 6$电子的大$\rm \pi$键,故推测$\rm Se$周围的价层电子对数为$\rm 2+1=3$,则其杂化方式为$\rm sp^{2}$,$\rm D$错误。
不能使溴的四氯化碳溶液褪色,说明该分子中没有碳碳双键,即存在一个$\rm 5$原子$\rm 6$电子的大$\rm \pi$键,故推测$\rm Se$周围的价层电子对数为$\rm 2+1=3$,则其杂化方式为$\rm sp^{2}$,$\rm D$错误。
高中 | 原子的基态与激发态、光谱题目答案及解析(完整版)
