高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
一种综合回收电解锰工业废盐$\rm ($主要成分为$\text{M}{{\text{n}}^{\text{2+}}}、\text{M}{{\text{g}}^{\text{2+}}}、\text{NH}_{\text{4}}^{+}$的硫酸盐$\rm )$的工艺流程如下。
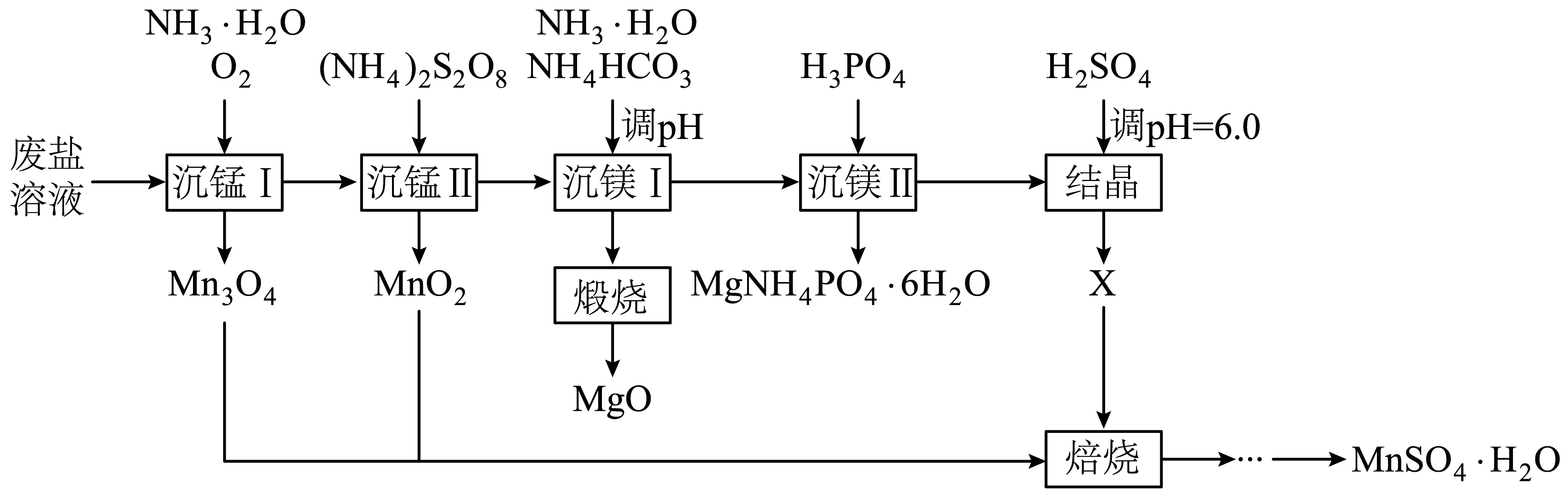
已知:①常温下${{K}_{\text{sp}}}\left( \text{MgC}{{\text{O}}_{\text{3}}} \right)\text{=1}{{\text{0}}^{\text{-5}\text{.17}}}$,${{K}_{\text{sp}}}\left[ \text{Mg(OH}{{\text{)}}_{\text{2}}} \right]\text{=1}{{\text{0}}^{\text{-11}\text{.25}}}$,${{K}_{\text{sp}}}\left[ \text{Mn(OH}{{\text{)}}_{\text{2}}} \right]\text{=1}{{\text{0}}^{\text{-12}\text{.72}}}$;
②${{\text{S}}_{\text{2}}}\text{O}_{\text{8}}^{\text{2-}}$结构式为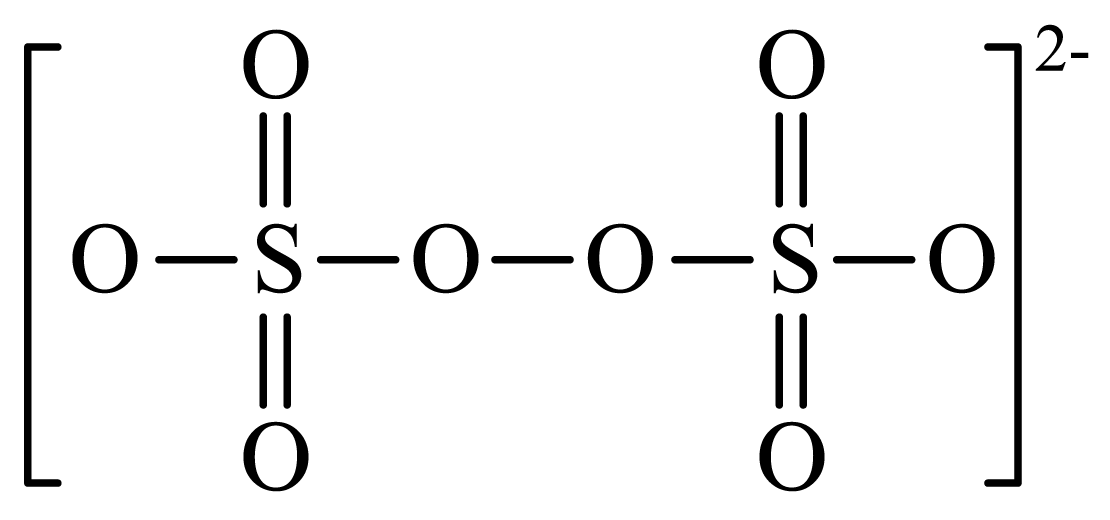 。
。
回答下列问题:
制备废盐溶液时,为加快废盐溶解,可采取的措施有 、 。$\rm ($写出两种$\rm )$
搅拌 ; 适当升温等
"]]加快废盐的溶解可以采取搅拌、适当升温、粉碎等;
“沉锰$\rm I$”中,写出形成的$\text{Mn(OH}{{\text{)}}_{\text{2}}}$被氧化成$\text{M}{{\text{n}}_{\text{3}}}{{\text{O}}_{\text{4}}}$的化学方程式 。当$\text{M}{{\text{g}}^{\text{2+}}}\left( c\text{=1}{{\text{0}}^{\text{-0}\text{.68}}}\text{ mol}\cdot {{\text{L}}^{\text{-1}}} \right)$将要开始沉淀时,溶液中剩余$\text{M}{{\text{n}}^{\text{2+}}}$浓度为 $\;\rm \text{mol}\cdot {{\text{L}}^{\text{-1}}}$。
$\\rm 6Mn(OH)_{2}+O_{2}=2Mn_{3}O_{4}+6H_{2}O$ ; $\\rm 10^{-2.15}$
"]]$\rm Mn(OH)_{2}$被$\rm O_{2}$氧化得到$\rm Mn_{3}O_{4}$,化学方程式为:$\rm 6Mn(OH)_{2}+O_{2}=2Mn_{3}O_{4}+6H_{2}O$;
根据$\dfrac{c\left( \text{M}{{\text{g}}^{2+}} \right)}{c\left( \text{M}{{\text{n}}^{2+}} \right)}=\dfrac{{{K}_{\text{sp}}}[\text{Mg}\left( \text{OH}{{)}_{2}} \right]}{{{K}_{\text{sp}}}[\text{Mn}\left( \text{OH}{{)}_{2}} \right]}=\dfrac{{{10}^{-0.68}}}{c\left( \text{M}{{\text{n}}^{2+}} \right)}\rm =\dfrac{{{10}^{-11.25}}}{{{10}^{-12.72}}}$,$c\left( \text{M}{{\text{n}}^{2+}} \right)\rm =10^{-2.15}$ $\rm mol/L$;
“沉锰Ⅱ”中,过量的${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}}$经加热水解去除,最终产物是$\text{N}{{\text{H}}_{\text{4}}}\text{HS}{{\text{O}}_{\text{4}}}$和 $\rm ($填化学式$\rm )$。
$\\rm O_{2}$
"]]“沉锰Ⅱ”中,过量的${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}}$经加热水解去除,${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}}$中存在过氧键,在加热和水存在下发生水解,生成$\text{N}{{\text{H}}_{\text{4}}}\text{HS}{{\text{O}}_{\text{4}}}$和${{\text{H}}_{\text{2}}}{{\text{O}}_{2}}$:${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{8}}+2{{\text{H}}_{2}}\text{O}=2\text{N}{{\text{H}}_{\text{4}}}\,\text{HS}{{\text{O}}_{4}}+{{\text{H}}_{2}}{{\text{O}}_{2}}$,${{\text{H}}_{\text{2}}}{{\text{O}}_{2}}$分解$\text{2}{{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\text{=2}{{\text{H}}_{\text{2}}}\text{O+}{{\text{O}}_{\text{2}}}\uparrow $,总反应为$\text{2}{{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{8}}+2{{\text{H}}_{2}}\text{O}=4\text{N}{{\text{H}}_{\text{4}}}\,\text{HS}{{\text{O}}_{4}}+{{\text{O}}_{2}}\uparrow $,最终产物是$\text{N}{{\text{H}}_{\text{4}}}\text{HS}{{\text{O}}_{\text{4}}}$和$\rm O_{2}$;
“沉镁$\rm I$”中,当$\text{pH}$为$\rm 8.0$~$\rm 10.2$时,生成碱式碳酸镁$\left[ x\text{MgC}{{\text{O}}_{\text{3}}}\cdot y\text{Mg(OH}{{\text{)}}_{\text{2}}}\cdot z{{\text{H}}_{\text{2}}}\text{O} \right]$,煅烧得到疏松的轻质$\text{MgO}$。$\text{pH}$过大时,不能得到轻质$\text{MgO}$的原因是 。
$\\rm pH$过大,沉淀为$\\rm Mg(OH)_{2}$,不能分解产生$\\rm CO_{2}$,不能得到疏松的轻质$\\text{MgO}$
"]]$\left[ x\text{MgC}{{\text{O}}_{\text{3}}}\cdot y\text{Mg(OH}{{\text{)}}_{\text{2}}}\cdot z{{\text{H}}_{\text{2}}}\text{O} \right]$煅烧有$\rm CO_{2}$生成,可以得到疏松的轻质氧化镁,$\rm pH$过大,沉淀为$\rm Mg(OH)_{2}$,不能分解产生$\rm CO_{2}$,不能得到疏松的轻质$\text{MgO}$;
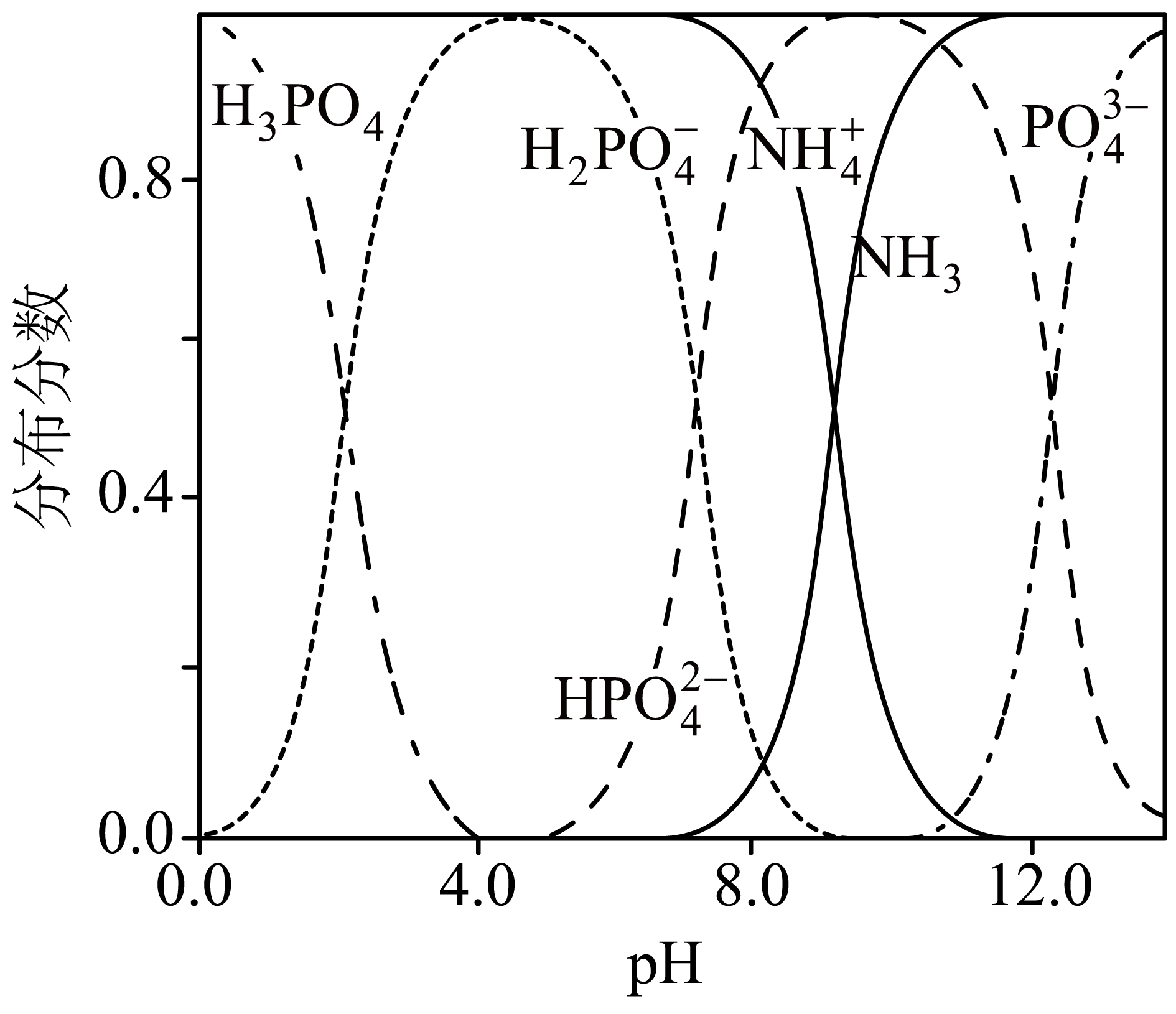
“沉镁Ⅱ”中,加${{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{4}}}$至$\text{pH=8}\text{.0}$时,$\text{M}{{\text{g}}^{\text{2+}}}$沉淀完全;若加至$\text{pH=4}\text{.0}$时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式 。
$\\text{MgHP}{{\\text{O}}_{4}}+{{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}=\\text{M}{{\\text{g}}^{2+}}+2{{\\text{H}}_{\\text{2}}}\\text{PO}_{4}^{-}$
"]]由图可知,$\rm pH=8$时,阴离子为$\text{HPO}_{4}^{2-}$,阳离子为$\text{M}{{\text{g}}^{2+}}$,产生的沉淀为$\text{MgHP}{{\text{O}}_{4}}$,调节到$\rm pH=4$,磷元素存在形式为${{\text{H}}_{\text{2}}}\text{PO}_{4}^{-}$,磷酸不是强酸,不能拆,离子方程式为:$\text{MgHP}{{\text{O}}_{4}}+{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}=\text{M}{{\text{g}}^{2+}}+2{{\text{H}}_{\text{2}}}\text{PO}_{4}^{-}$
“结晶”中,产物$\rm X$的化学式为 。
$\\rm (NH_{4})_{2}SO_{4}$
"]]溶液中存在铵根离子和硫酸根离子,结晶后$\rm X$为$\rm (NH_{4})_{2}SO_{4}$;
“焙烧”中,$\text{Mn}$元素发生了 $\rm ($填“氧化”或“还原”$\rm )$反应。
还原
"]]“焙烧”中,$\rm Mn_{3}O_{4}$和$\rm MnO_{2}$最终生成$\rm MnSO_{4}·H_{2}O$,$\text{Mn}$元素化合价降低,发生了还原反应。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
