高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
乳酸亚铁固体$\rm {{\left[ \text{C}{{\text{H}}_{3}}\text{CH}\left( \text{OH} \right)\text{COO} \right]}_{2}}\text{Fe}$,摩尔质量:$234\text{ g}\cdot \text{mo}{{\text{l}}^{-1}}$是一种很好的补铁剂,它易溶于水,难溶于乙醇,其水溶液易被氧化,可由乳酸与$\text{FeC}{{\text{O}}_{3}}$反应制得。
Ⅰ.制备碳酸亚铁:可在还原性气氛中,用亚铁盐与$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液制备,已知碳酸亚铁干燥品在空气中比较稳定,而湿品在空气中被氧化为$\text{Fe}{{\left( \text{OH} \right)}_{3}}$变成茶色$\rm ($反应体系均为水相,所有试剂均在图中$\rm )$。装置如下图所示。回答下列问题:
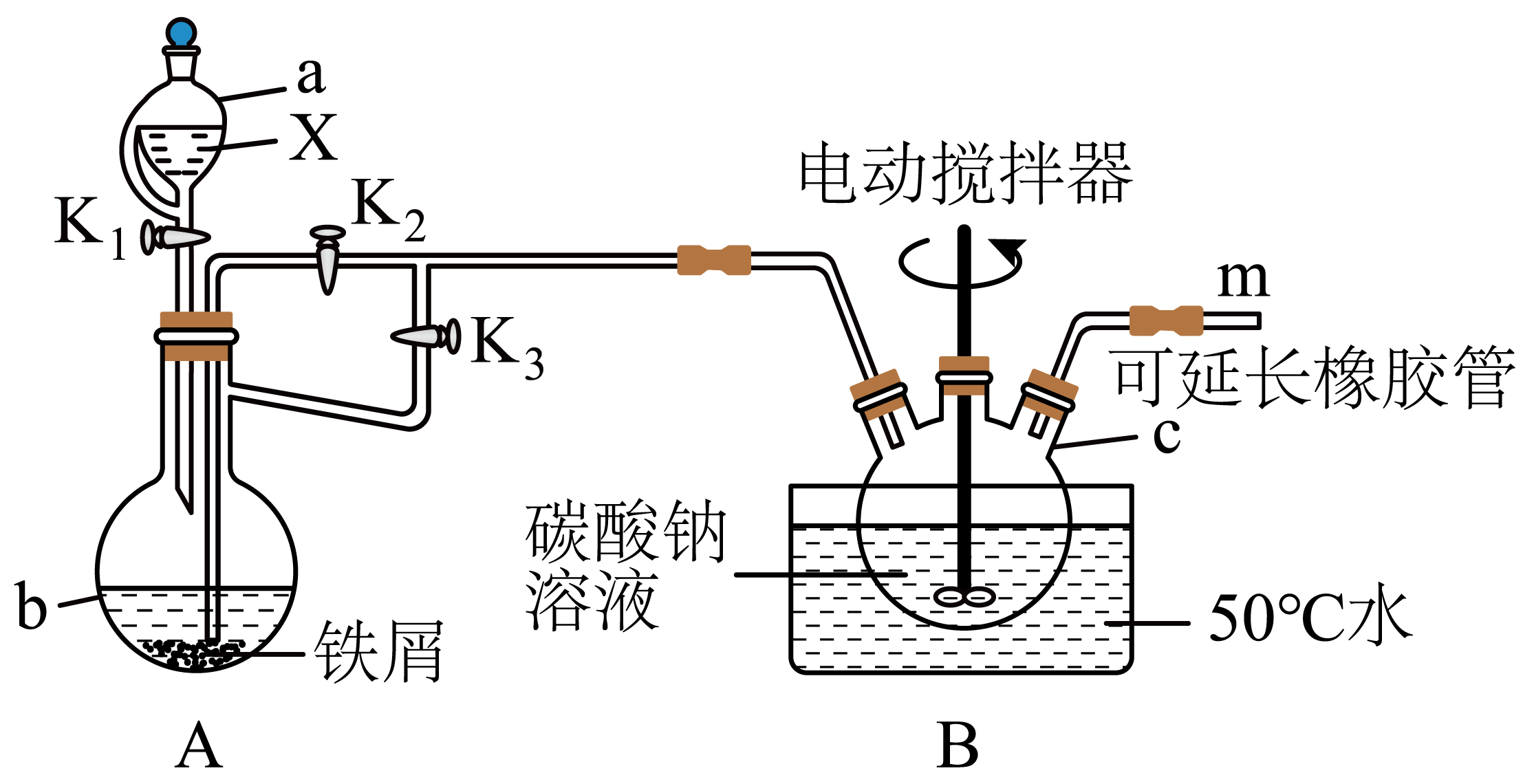
仪器$\rm b$的名称为 。
蒸馏烧瓶
"]]由仪器构造可知,仪器$\rm b$的名称为蒸馏烧瓶;
试剂$\rm X$的最佳选择是 $\rm ($填标号$\rm )$。
$\rm A$.$\rm 98\%$硫酸溶液 $\rm B$.$\rm 37\%$盐酸 $\rm C$.$\rm 20\%$硫酸溶液 $\rm D$.$\rm 30\%$硝酸溶液
$\\rm C$
"]]$\rm A$.常温下,铁屑与$\rm 98\%$硫酸溶液会发生钝化反应,$\rm A$不符合题意;
$\rm B$.$\rm 37\%$盐酸具有挥发性,$\rm HCl$会挥发至三颈烧瓶中而消耗$\rm Na_{2}CO_{3}$,导致$\rm \text{FeC}{{\text{O}}_{3}}$产率降低,$\rm B$不符合题意;
$\rm C$.$\rm 20\%$硫酸溶液与铁屑反应生成氢气和$\rm \text{FeS}{{\text{O}}_{\text{4}}}$,能达到实验目的,$\rm C$符合题意;
$\rm D$.$\rm 30\%$硝酸溶液具有强氧化性,可能继续将生成的$\rm \text{F}{{\text{e}}^{\text{2+}}}{}$氧化为$\rm \text{F}{{\text{e}}^{\text{3+}}}{}$,$\rm D$不符合题意;
向气密性良好的装置中添加药品。打开${{\text{K}}_{1}}$、${{\text{K}}_{3}}$,关闭${{\text{K}}_{2}}$,待在$\text{m}$处检验到较纯净的${{\text{H}}_{2}}$后,先将 $\rm ($补充操作$\rm )$,再关闭${{\text{K}}_{1}}$、${{\text{K}}_{3}}$,打开${{\text{K}}_{2}}$,$\text{B}$中出现白色浑浊。
$\\rm m$插入装有水的烧杯中$\\rm ($隔绝空气的装置即可得分,不能夹住$\\rm )$
"]]$\text{FeC}{{\text{O}}_{3}}$湿品在空气中会被氧化,需要隔绝空气,所以向气密性良好的装置中添加药品。打开$\rm {{\text{K}}_{1}}$、$\rm {{\text{K}}_{3}}$,关闭$\rm {{\text{K}}_{2}}$,待在$\rm \text{m}$处检验到较纯净的$\rm {{\text{H}}_{2}}$后,先将$\rm m$插入装有水的烧杯中$\rm ($隔绝空气的装置即可得分,不能夹住$\rm )$,再关闭$\rm {{\text{K}}_{1}}$、$\rm {{\text{K}}_{3}}$,打开$\rm {{\text{K}}_{2}}$,$\rm \text{B}$中出现白色浑浊;
碳酸亚铁在潮湿空气中变茶色的化学方程式为 。
$4\\text{FeC}{{\\text{O}}_{3}}+6{{\\text{H}}_{2}}\\text{O}+{{\\text{O}}_{2}}=4\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}+4\\text{C}{{\\text{O}}_{2}}$
"]]$\text{FeC}{{\text{O}}_{3}}$在潮湿空气中被氧化为$\text{Fe}{{\left( \text{OH} \right)}_{3}}$而变成茶色,反应的化学方程式为:$4\text{FeC}{{\text{O}}_{3}}+6{{\text{H}}_{2}}\text{O}+{{\text{O}}_{2}}=4\text{Fe}{{\left( \text{OH} \right)}_{3}}+4\text{C}{{\text{O}}_{2}}$;
碳酸亚铁在热空气中发生吸热反应:$4\text{FeC}{{\text{O}}_{3}}+{{\text{O}}_{\text{2}}}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}2\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}+4\text{C}{{\text{O}}_{2}}$,则碳酸亚铁可用作阻燃剂的原因是消耗${{\text{O}}_{2}}$、生成$\text{C}{{\text{O}}_{2}}$、 、生成$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$覆盖在燃烧物表面。
吸收热量$\\rm ($或降低可燃物的温度$\\rm )$
"]]该反应为吸热反应,能吸收热量$\rm ($或降低可燃物的温度$\rm )$,则碳酸亚铁可用作阻燃剂的原因是消耗${{\text{O}}_{2}}$、生成$\text{C}{{\text{O}}_{2}}\rm ($不支持燃烧$\rm )$、吸收热量$\rm ($或降低可燃物的温度$\rm )$、生成$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$覆盖在燃烧物表面;
Ⅱ.制备乳酸亚铁并测定样品中铁元素的含量:
将制得的$\text{FeC}{{\text{O}}_{3}}$加入乳酸溶液中,加入少量铁粉,在$\rm 75$ $\rm ^\circ\rm C$下搅拌使之充分反应,然后再加入适量乳酸,经系列操作后得到产品。
称取$5.0\text{ g}$样品,灼烧至完全灰化,加盐酸溶解配成$250\;\rm \text{mL}$溶液,取$25.00\;\rm \text{mL}$于锥形瓶中,加入过量$\text{KI}$溶液充分反应,然后加入$\rm 1\sim 2$滴淀粉溶液,用$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$硫代硫酸钠标准溶液滴定,滴定终点时,测得消耗标准溶液$20.00\;\rm \text{mL}$。$\rm ($已知:${{\text{I}}_{2}}+2{{\text{S}}_{2}}\text{O}_{3}^{2-}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}\rm )$
样品中铁元素的质量分数是 。
$\\rm 22.4\\%$
"]]将样品灼烧至完全灰化,生成氧化铁,再加入盐酸溶解生成氯化铁,取$25.00\;\rm \text{mL}$于锥形瓶中,加入过量$\text{KI}$溶液充分反应:$\text{2F}{{\text{e}}^{\text{3+}}}\text{+2}{{\text{I}}^{-}}\text{=2F}{{\text{e}}^{\text{2+}}}+{{\text{I}}_{\text{2}}}$,再用$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$硫代硫酸钠标准溶液滴定,发生反应:${{\text{I}}_{2}}+2{{\text{S}}_{2}}\text{O}_{3}^{2-}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$,可得关系式:$\text{2 }\!\![\!\!\text{ C}{{\text{H}}_{\text{3}}}\text{CH}\left( \text{OH} \right)\text{COO}{{]}_{2}}\text{Fe}\sim 2\text{F}{{\text{e}}^{\text{3+}}}\sim {{\text{I}}_{\text{2}}}\sim 2{{\text{S}}_{2}}\text{O}_{3}^{2-}$,则样品中铁元素的质量分数是:$\dfrac{\text{0}\text{.1 mol/L}\times \text{20}\times \text{1}{{\text{0}}^{\text{-3}}}\text{ L}\times \dfrac{\text{250}}{\text{25}}\times \text{56 g/mol}}{\text{5}\text{.0 g}}\times \text{100 }\!\!\%\!\!\text{ =22}\text{.4 }\!\!\%$;
若用酸性$\text{KMn}{{\text{O}}_{4}}$溶液直接滴定样品,测得铁元素含量大于$100\%$,其原因是 。
酸性$\\text{KMn}{{\\text{O}}_{4}}$溶液可以氧化乳酸根$\\rm ($或乳酸$\\rm )$,导致标准液消耗量偏多
"]]乳酸亚铁中含有羟基,能被酸性$\text{KMn}{{\text{O}}_{4}}$溶液氧化,导致酸性$\text{KMn}{{\text{O}}_{4}}$溶液实际消耗量大于与$\text{F}{{\text{e}}^{\text{2+}}}$反应的酸性$\text{KMn}{{\text{O}}_{4}}$溶液用量,所以若用酸性$\text{KMn}{{\text{O}}_{4}}$溶液直接滴定样品,测得铁元素含量大于$100\%$,其原因是:酸性$\text{KMn}{{\text{O}}_{4}}$溶液可以氧化乳酸根$\rm ($或乳酸$\rm )$,导致标准液消耗量偏多。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
