高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
铜是一种过渡金属,在自然界既以化合态存在$\rm ($如黄铜矿$\rm )$,又以游离态存在。一种以黄铜矿$\rm ($主要成分为$\rm CuFe{{S}_{2}}$,含少量$\rm Fe$的氧化物、$\rm Au$等$\rm )$为原料制备纳米$\rm Cu$的工艺流程如图。下列说法正确的是$\rm (\qquad)$
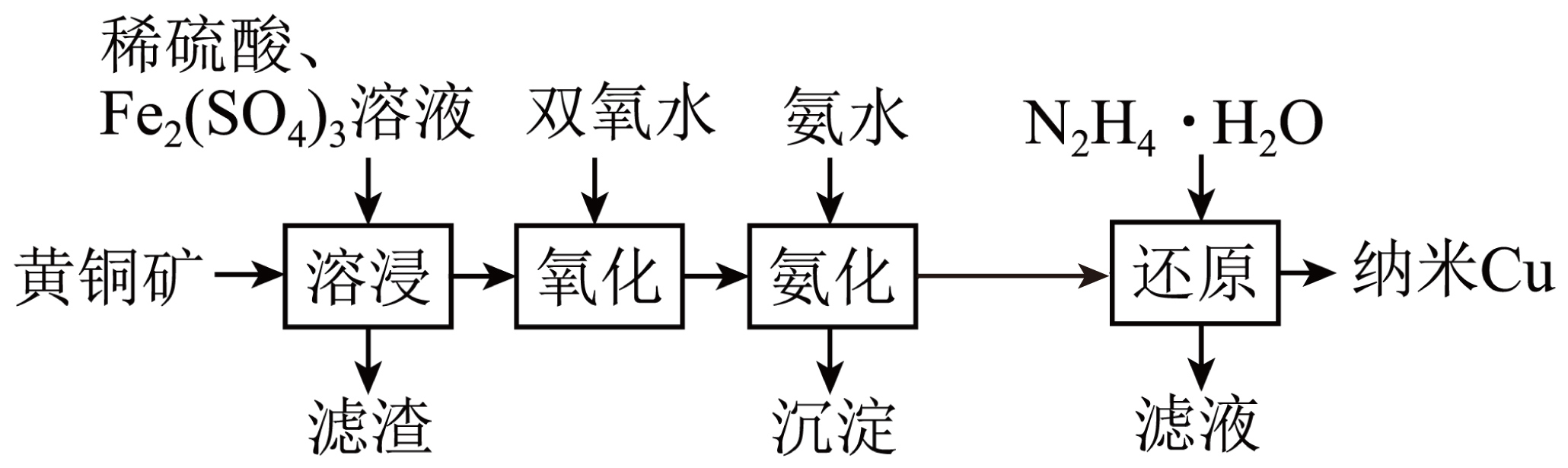
“溶浸”过程的主要反应的离子方程式为$\\rm {{S}^{2-}}+2F{{e}^{3+}}=S\\downarrow +2F{{e}^{2+}}$
","“氨化”后的滤液为深蓝色
","电解精炼粗铜,当阳极有$\\rm 2\\ mol$电子转移时,阴极生成$\\rm 2\\ mol$铜
","氧化时加入的双氧水无需过量,也可保证$\\rm F{{e}^{2+}}$完全被氧化
"]黄铜矿的主要成分为$\rm CuFeS_{2}$,含少量$\rm Fe$的氧化物、$\rm SiO_{2}$、$\rm Au$等,加入稀硫酸和硫酸铁溶液溶浸,$\rm Fe^{3+}$具有氧化性,可氧化硫元素得到$\rm S$,同时$\rm Cu^{2+}$、$\rm Fe^{3+}$、$\rm SO_{4}^{2-}$和$\rm Fe^{2+}$留在溶液中,加入双氧水可氧化$\rm Fe^{2+}$,然后用氨水氨化$\rm Cu^{2+}$,同时产生$\rm Fe(OH)_{3}$沉淀,最后用水合肼还原$\rm [Cu(NH_{3})_{4}]SO_{4}$得到纳米铜,滤液的主要溶质为$\rm (NH_{4})_{2}SO_{4}$。
$\rm A$.黄铜矿的主要成分为$\rm CuFeS_{2}$,“溶浸”过程是三价铁和$\rm CuFeS_{2}$的反应,离子方程式为:$\rm CuFe{{S}_{2}}+4F{{e}^{3+}}=5F{{e}^{2+}}+C{{u}^{2+}}+2S$,$\rm A$错误。
$\rm B$.“氨化”后生成四氨合铜离子,则溶液为深蓝色,$\rm B$正确。
$\rm C$.阴极电极反应为:$\rm Cu^{2+}+2e^{-}=Cu$,则阳极有$\rm 2\ mol$电子转移时,阴极生成$\rm 1\ mol$铜,$\rm C$错误。
$\rm D$.铜离子和三价铁都可以催化过氧化氢分解,为了保证$\rm F{{e}^{2+}}$完全被氧化,双氧水需过量,$\rm D$错误。
故选:$\rm B$
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
