高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
稀土金属钪$\rm (Sc)$及其化合物在电子、超导合金和催化剂等领域有重要应用。以工业钛白水解废酸液$\rm ($含$\rm S{{c}^{3+}}、Ti{{O}^{2+}}、F{{e}^{3+}}、{{H}^{+}}、SO_{4}^{2-}$等离子$\rm )$为原料,制取氧化钪$\rm (S{{c}_{2}}{{O}_{3}})$和单质钪的工艺流程如图:
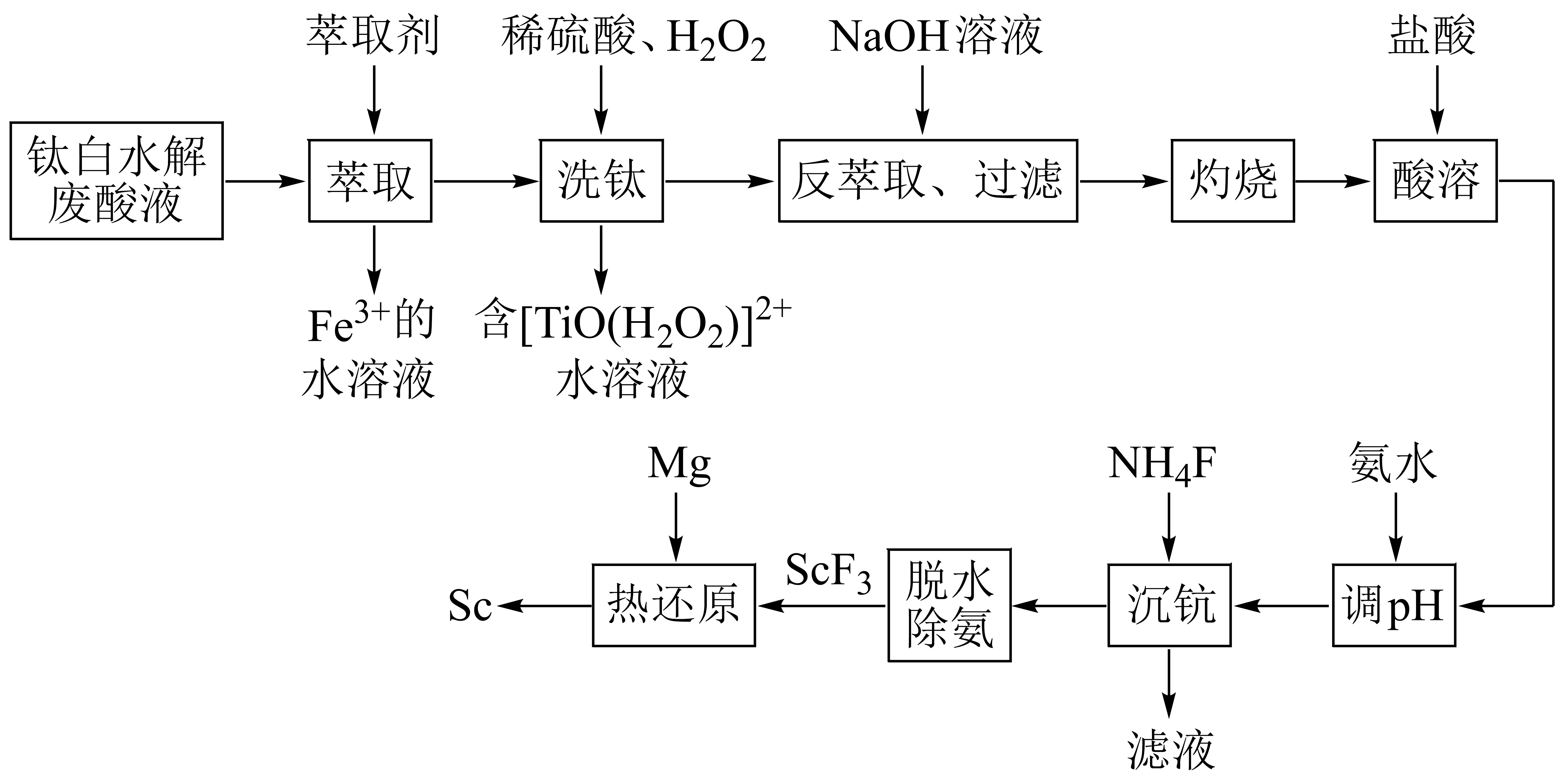
已知:①${{K}_{\rm sp}}\rm \left[ Sc{{(OH)}_{3}} \right]=8.1\times {{10}^{-31}}$
②“沉钪”所得固体是水合复盐沉淀,其化学式为$\rm 3N{{H}_{4}}Cl\cdot Sc{{F}_{3}}\cdot 6{{H}_{2}}O$
在酸洗时,加入$\rm {{H}_{2}}{{O}_{2}}$的作用是 。
作配体$\\rm ($或形成配合物$\\rm )$
"]]由分析可知$\rm TiO^{2+}$加入$\rm H_{2}O_{2}$后,$\rm TiO^{2+}$与$\rm H_{2}O_{2}$结合形成$\rm [TiO(H_{2}O_{2})]^{2+}$,该转化过程元素化合价没发生变化,应该是$\rm H_{2}O_{2}$中的氧原子提供孤电子对,$\rm TiO^{2+}$中$\rm Ti$原子提供空轨道,形成配合物,故$\rm {{H}_{2}}{{O}_{2}}$的作用是作配体。
反萃取步骤中,加入$\rm NaOH$溶液后生成$\rm Sc{{(OH)}_{3}}$沉淀。若沉淀后溶液的$\rm pH=8($常温下$\rm )$,则残留的$\rm S{{c}^{3+}}$的物质的量浓度是 。
$\\rm 8.1\\times {{10}^{-13}}\\ mol/L$
"]]若沉淀后溶液的$\rm pH=8($常温下$\rm )$,$c{\rm (OH^{-})}=10^{-6}\rm \ mol/L$,则残留的$\rm Sc^{3+}$的物质的量浓度是$ \dfrac{{{K}_{\rm sp}} \rm [ Sc{\rm (OH{{)}}_{3}}] }{{{c}^{3}}\rm (O{{H}^{-}})}=\dfrac{8.1\times {{10}^{-31}}}{{{(1\times {{10}^{-6}})}^{3}}}=8.1\times {{10}^{-13}}\rm \ mol/L$。
“灼烧”得到$\rm S{{c}_{2}}{{O}_{3}}$。若灼烧$\rm S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}\cdot 6{{H}_{2}}O$也能得到$\rm S{{c}_{2}}{{O}_{3}}$,其在空气中热分解温度区间和分解得到的固体产物如下表所示:
| 草酸钪晶体 | 热分解温度区间$(\rm K)$ | 固体失重百分率$\rm (\%)$ | 生成的含钪化合物 |
| ${\rm S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}\cdot 6{{H}_{2}}O}(M=462\rm \ g/mol)$ | $\rm 383\sim423$ | $\rm 19.48$ | $\rm A$ |
| $\rm 463\sim508$ | $\rm 23.38$ | $\rm S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}$ | |
| $\rm 583\sim873$ | $\rm 70.13$ | $\rm S{{c}_{2}}{{O}_{3}}$ |
含钪化合物$\rm A$的化学式为 ,由$\rm S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}$转化为$\rm S{{c}_{2}}{{O}_{3}}$时,发生反应的化学方程式为 。
$\\rm S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}\\cdot {{H}_{2}}O$;$\\rm 2S{{c}_{2}}{{({{C}_{2}}{{O}_{4}})}_{3}}+3{{O}_{2}}\\begin{matrix} \\underline{\\underline{\\triangle }} \\\\ {} \\\\ \\end{matrix}2S{{c}_{2}}{{O}_{3}}+12C{{O}_{2}}$
"]]在温度为$\rm 383\sim 423\ K$时,$\rm Sc_{2}(C_{2}O_{4})_{3}\cdot 6H_{2}O$的失重百分率为$\rm 19.48\%$,则失去质量为$\rm 462\times 0.1948=90$,若失重质量为水的质量,则失去水的数目为$n{\rm (H_{2}O)}=\dfrac{90}{18}=5$,故生成的含钪化合物$\rm A$化学式为$\rm Sc_{2}(C_{2}O_{4})_{3}\cdot H_{2}O$。
由$\rm Sc_{2}(C_{2}O_{4})_{3}$在空气中煅烧转化为$\rm Sc_{2}O_{3}$时,反应同时产生$\rm CO_{2}$气体,根据电子守恒、原子守恒,可得发生反应的化学方程式为:$\rm 2Sc_{2}(C_{2}O_{4})_{3}+3O_{2}\begin{matrix} \underline{\underline{\triangle}} \\ {} \\\end{matrix}2Sc_{2}O_{3}+12CO_{2}$。
传统制备$\rm Sc{{F}_{3}}$的方法是先得到$\rm Sc{{F}_{3}}\cdot 6{{H}_{2}}O$,再高温脱水得到$\rm Sc{{F}_{3}}$,但所得$\rm Sc{{F}_{3}}$通常含有$\rm ScOF$杂质,原因是 $\rm ($用化学方程式表示$\rm )$。该流程中,“脱水除铵”可制得高纯度$\rm Sc{{F}_{3}}$,原因是 。
$\\rm Sc{{F}_{3}}+{{H}_{2}}O\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}ScOF+2H($或$\\rm Sc{{F}_{3}}\\cdot 6{{H}_{2}}O\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}ScOF+2HF+5{{H}_{2}}O)$;“除铵”时$\\rm N{{H}_{4}}Cl$分解生成$\\rm HCl$,抑制$\\rm S{{c}^{3+}}$水解
"]]$\rm ScF_{3}\cdot 6H_{2}O$高温脱水得到$\rm ScF_{3}$,但通常含有$\rm ScOF$杂质,原因是高温脱水时,$\rm ScF_{3}$会与水反应生成$\rm ScOF$,结合原子守恒,反应的化学方程式为$\rm ScF_{3}+H_{2}O\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}ScOF+2HF($或$\rm ScF_{3}\cdot 6H_{2}O\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}ScOF+2HF+5H_{2}O)$;流程中“沉钪”后“脱水除铵”可制得高纯度$\rm ScF_{3}$的原因是“除铵”时$\rm NH_{4}Cl$分解生成$\rm HCl$,抑制$\rm Sc^{3+}$的水解。
含钪元素的微粒与${\rm pF[ pF=-lg}c{\rm ({{F}^{-}})} ]\rm pH$的关系如图所示,用氨水调节溶液的$\rm pH$最好小于 ,“沉钪”所得滤液中$c{\rm ({{F}^{-}})}$应大于 $\rm {mol} \cdot {L}^{-1}$。
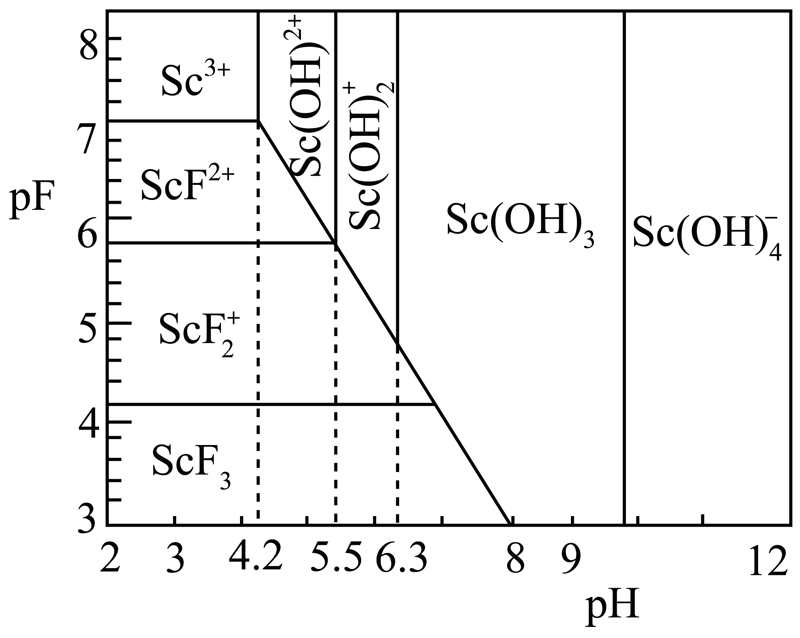
$\\rm 4.2$;$\\rm {{10}^{-4.2}}$
"]]由流程可知,加氨水调$\rm pH$维持$\rm Sc$以$\rm Sc^{3+}$形式存在,以便后续与$\rm F^{-}$结合生成$\rm ScF_{3}$,还需防止$\rm Sc^{3+}$与$\rm OH^{-}$结合,故调节溶液的$\rm pH$最好小于$\rm 4.2$;由图可知,“沉钪”需要将$\rm Sc^{3+}$转化为$\rm ScF_{3}$,$\rm pF$应小于$\rm 4.2$,则$c{\rm (F^{-})}$应大于$\rm 1.0\times 10^{-4.2}\ mol\cdot L^{-1}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
