高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
镍和钴广泛应用于磁性材料、高温合金的制造。利用红土镍矿$\rm [$主要含$\rm Ni{{(OH)}_{2}}$,还含有$\rm Co$、$\rm Fe$、$\rm Al$、$\rm Mn$、$\rm Si$等元素$\rm ]$提取$\rm Ni$、$\rm Co$的工艺流程如下。
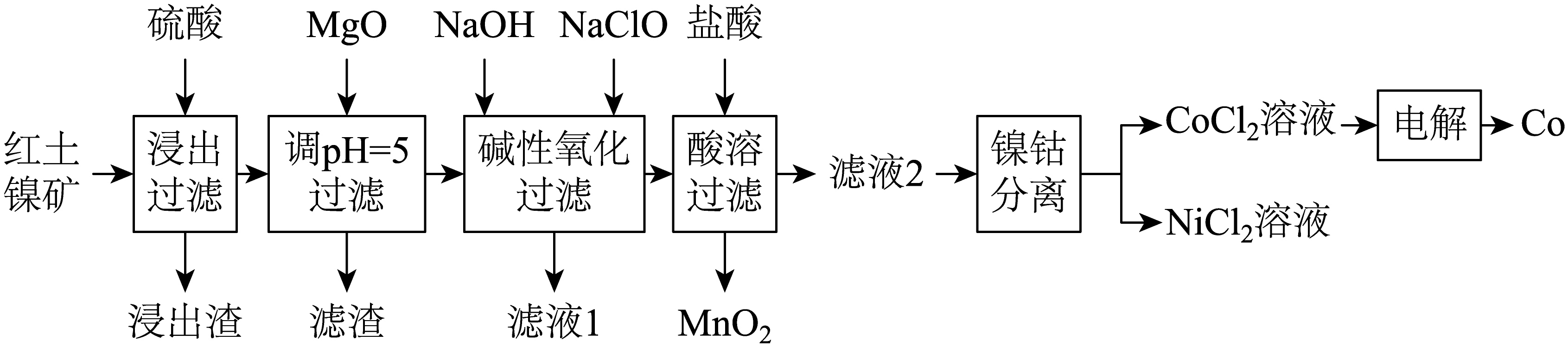
已知:碱性条件下,$\rm Co{{(OH)}_{2}}$易被氧化为$\rm Co{{(OH)}_{3}}$;酸性条件下,$\rm Co{{(OH)}_{3}}$具有强氧化性,易被还原成$\rm C{{o}^{2+}}$。部分氢氧化物的${{K}_{\rm sp}}$如下表。
| 氢氧化物 | $\rm Co{{(OH)}_{2}}$ | $\rm Co{{(OH)}_{3}}$ | $\rm Ni{{(OH)}_{2}}$ | $\rm Al{{(OH)}_{3}}$ | $\rm {Mg}{{({OH})}_{{2}}}$ | $\rm Fe{{(OH)}_{3}}$ |
| ${{K}_{\rm sp}}$ | $\rm 5.9 \times 10^{-15}$ | $\rm 1.6\times {{10}^{-44}}$ | $\rm 5.5\times {{10}^{-16}}$ | $\rm 1.3\times {{10}^{-33}}$ | $\rm 6.0\times {{10}^{-12}}$ | $\rm 2.8\times {{10}^{-39}}$ |
“浸出过滤”所得滤液中主要含有$\rm N{{i}^{2+}}$、$\rm C{{o}^{2+}}$、$\rm F{{e}^{3+}}$、$\rm A{{l}^{3+}}$、$\rm M{{n}^{2+}}$。基态$\rm N{{i}^{2+}}$的电子排布式为 。
$\\rm 3d^{8}$
"]]$\rm Ni$是$\rm 28$号元素,基态$\rm N{{i}^{2+}}$的电子排布式为$\rm 3d^{8}$。
滤渣的主要成分为 。
$\\rm Al{{(OH)}_{3}}$、$\\rm Fe{{(OH)}_{3}}$
"]]当离子浓度小于或等于$\rm 1\times 10^{-5}\ mol/L$时,可认为沉淀完全,滤液中加入$\rm MgO$调$\rm pH$,$\rm pH=5$时,$c{\rm (H^{+})}=1\times 10^{-5}\rm \ mol/L$,$c{\rm (OH^{-})}=1\times 10^{-9}\rm \ mol/L$,根据提供的物质$K_{\rm sp}$可得,$c{\rm (A{{l}^{3+}})}=\dfrac{{{K}_{\rm sp}}\rm \left[ Al(OH{{)}_{3}} \right]}{{{c}^{3}}\rm (O{{H}^{-}})}=\dfrac{1.3\times {{10}^{-33}}}{{{({{10}^{-9}})}^{3}}}=1.3\times {{10}^{-6}}$,$c{\rm (F{{e}^{3+}})}=\dfrac{{{K}_{\rm sp}}\rm \left[ Fe(OH{{)}_{3}} \right]}{{{c}^{3}}\rm (O{{H}^{-}})}=\dfrac{2.8\times {{10}^{-39}}}{{{({{10}^{-9}})}^{3}}}=2.8\times {{10}^{-12}}$,因此滤渣的主要成分为$\rm Al{{(OH)}_{3}}$、$\rm Fe{{(OH)}_{3}}$。
“碱性氧化过滤”中,加入$\rm NaOH$、$\rm NaClO$氧化后过滤,所得滤饼的主要成分为$\rm Ni{{(OH)}_{2}}$、$\rm Co{{(OH)}_{3}}$和$\rm Mn{{O}_{2}}$,生成$\rm Mn{{O}_{2}}$的离子方程式为 。滤液$\rm 1$中$\rm M{{g}^{2+}}$浓度为$\rm 14.4\ g\cdot {{L}^{-1}}$,为防止滤饼中混入含$\rm Mg$杂质,过滤前需要调节溶液$\rm pH$小于 。
$\\rm Cl{{O}^{-}}+M{{n}^{2+}}+2O{{H}^{-}}=Mn{{O}_{2}}\\downarrow +C{{l}^{-}}+{{H}_{2}}O$;$\\rm 8.5$
"]]加入$\rm NaClO$将$\rm M{{n}^{2+}}$转化为$\rm Mn{{O}_{2}}$沉淀,$\rm NaClO$作氧化剂转化为$\rm Cl^{-}$,离子方程式为:$\rm Cl{{O}^{-}}+M{{n}^{2+}}+2O{{H}^{-}}=Mn{{O}_{2}}\downarrow +C{{l}^{-}}+{{H}_{2}}O$;滤液$\rm 1$中$\rm M{{g}^{2+}}$浓度为$\rm 14.4\ g\cdot {{L}^{-1}}$,转化为物质的量浓度为$c{\rm (M{{g}^{2+}})}=\rm \dfrac{14.4\ g\cdot {{L}^{-1}}}{24\ g/\operatorname{mol}}=0.6\operatorname{mol}/L$,开始沉淀时$c{\rm (O{{H}^{-}})}=\sqrt{\dfrac{{{K}_{\rm sp}}\rm \left[ Mg(OH{{)}_{2}} \right]}{c{\rm (M{{g}^{2+}})}}}=\sqrt{\dfrac{6.0\times {{10}^{-12}}}{0.6}}\ \rm \operatorname{mol}/L={{10}^{-5.5}}\ \operatorname{mol}/L$,$c{\rm ({{H}^{+}})}=\dfrac{{{K}_{\rm w}}}{c{\rm (O{{H}^{-}})}}=\dfrac{{{10}^{-14}}}{{{10}^{-5.5}}}\ \rm \operatorname{mol}/L={{10}^{-8.5}}\ \operatorname{mol}/L$,因此为防止滤饼中混入含$\rm Mg$杂质,过滤前需要调节溶液$\rm pH$小于$\rm 8.5$。
“酸溶”中有黄绿色气体生成,生成该气体的反应中氧化剂为 ;该气体用 溶液吸收后可循环至前面工序使用。
$\\rm Co{{(OH)}_{3}}$;$\\rm NaOH$
"]]碱性氧化时,$\rm C{{o}^{2+}}$被$\rm NaClO$氧化为$\rm Co{{(OH)}_{3}}$,酸性条件下,$\rm Co{{(OH)}_{3}}$具有强氧化性,将盐酸氧化为黄绿色气体$\rm Cl_{2}$,因此该反应中氧化剂为$\rm Co{{(OH)}_{3}}$;$\rm Cl_{2}$用$\rm NaOH$溶液吸收后生成$\rm NaClO$,$\rm NaClO$可循环至前面“碱性氧化”工序中使用。
“电解”中,装置如图所示。阴极的电极反应为 。电解后$\rm a$室中的电解质溶液可以返回 工序循环使用。
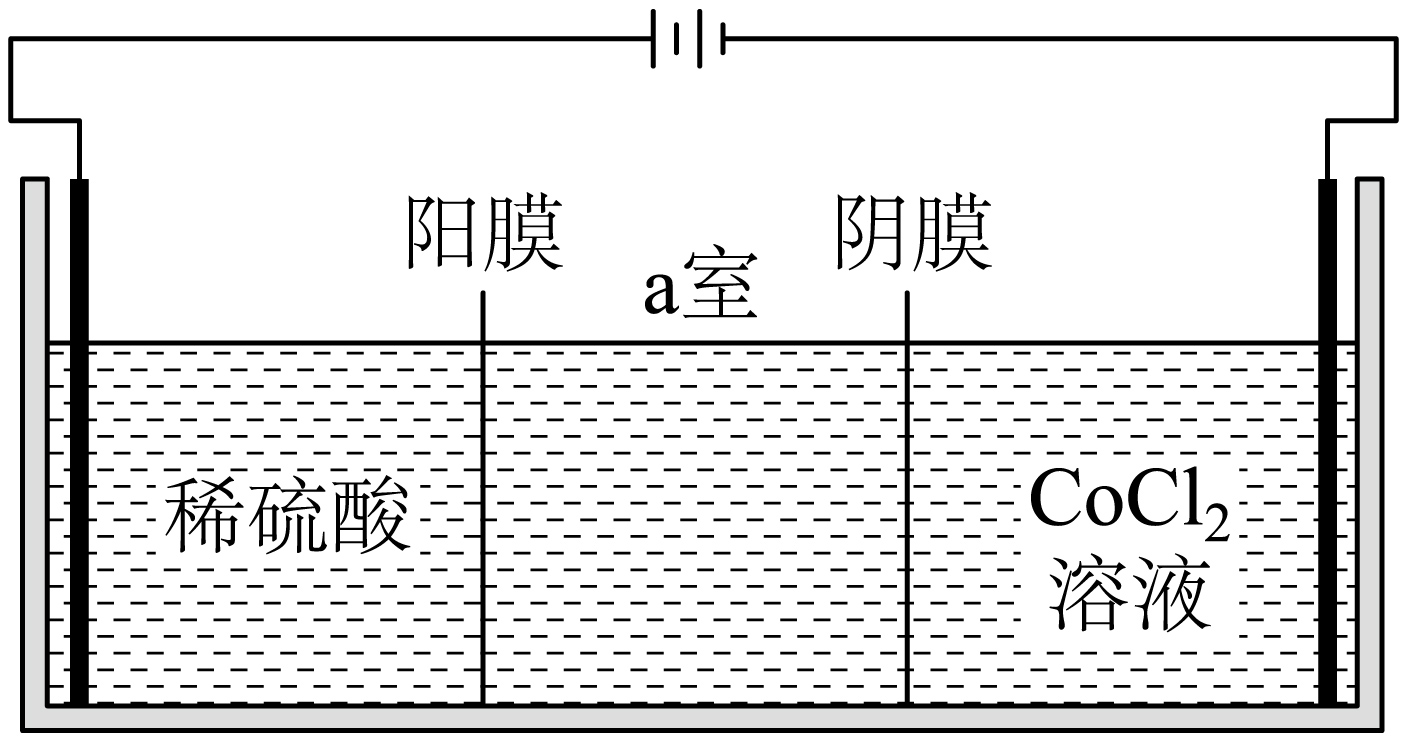
$\\rm C{{o}^{2+}}+2{{e}^{-}}=Co$;酸溶过滤
"]]“电解”装置中,左侧电极与电源正极相连,为阳极,右侧电极与电源负极相连,为阴极,阴极得到电子发生还原反应,电极反应为$\rm C{{o}^{2+}}+2{{e}^{-}}=Co$;阴极中$\rm Cl^{-}$向$\rm a$室移动,阳极中$\rm H^{+}$向$\rm a$室移动,因此电解后$\rm a$室中的电解质溶液主要为$\rm HCl$溶液,盐酸可以返回“酸溶过滤”工序循环使用。
由$\rm NiC{{l}_{2}}$可制备镍酸镧晶体,其立方晶胞如图。该镍酸镧的化学式为 ,若该立方晶胞参数为$a\ \rm nm$,则$\rm La$和$\rm O$的最小核间距为 $\rm \ nm$。
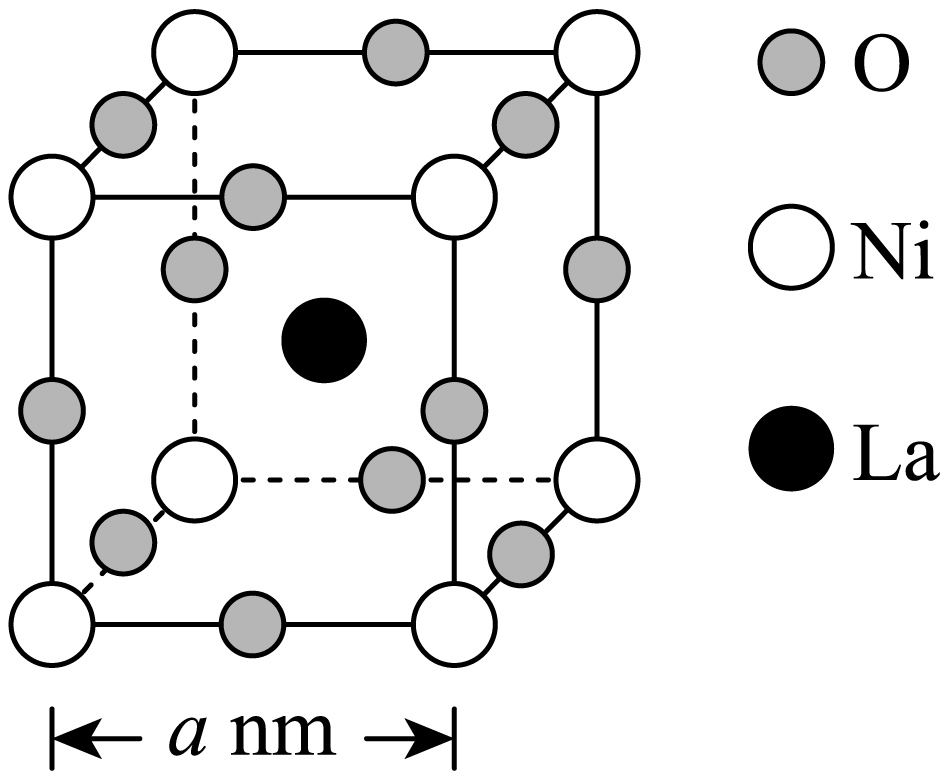
$\\rm LaNiO_{3}$;$\\dfrac{\\sqrt{2}}{2}a$
"]]由晶胞结构可知,该晶胞中$\rm O$、$\rm Ni$、$\rm La$的个数分别为$\rm 12\times \dfrac{1}{4}=3$、$\rm 8\times \dfrac{1}{8}=1$、$\rm 1$,因此该镍酸镧的化学式为$\rm LaNiO_{3}$;$\rm La$和$\rm O$的最小核间距为面对角线的一半,若该立方晶胞参数为$a\ \rm nm$,则$\rm La$和$\rm O$的最小核间距为$\dfrac{\sqrt{2}}{2}a\ \rm nm$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
